
Idoneidad climática de tres especies de vertebrados invasores en Áreas Naturales Protegidas en el noreste de México*
Jorge E. Ramírez-Albores**
Departamento de Botánica, Universidad Autónoma Agraria Antonio Narro (México)
Heliot Zarza***
Departamento de Ciencias Ambientales, Universidad Autónoma Metropolitana Unidad Lerma (México)
Marlín Pérez-Suárez****
Instituto de Ciencias Agropecuarias y Rurales, Universidad Autónoma del Estado de México (México)
José F. González-Maya*****
Departamento de Ciencias Ambientales, Universidad Autónoma Metropolitana Unidad Lerma (México)
J. Javier Ochoa-Espinoza******
Departamento de Recursos Naturales Renovables, Universidad Autónoma Agraria Antonio Narro (México)
Naturaleza y Sociedad. Desafíos Medioambientales • número 14 • enero-abril, 2026 • pp. 1-28
https://doi.org/10.53010/nys14.02
Recibido: 23 de mayo de 2025 | Aceptado: 21 de agosto de 2025
Resumen. Las Áreas Naturales Protegidas (ANP) son pilares fundamentales para la conservación de la biodiversidad, pero son vulnerables a múltiples presiones y, en particular, a sufrir invasiones biológicas por las constantes e intensas actividades humanas. La región noreste de México, que comprende Coahuila, Nuevo León y Tamaulipas, presenta alta biodiversidad y elevado endemismo, con más de 80 ANP. Sin embargo, en años recientes se ha registrado la presencia de especies exóticas invasoras (EEI) de alto potencial de propagación en esta región. En este trabajo se presenta un análisis de las invasiones biológicas a través de la evaluación de la idoneidad climática actual y futura de tres EEI: paloma de collar turca (Streptopelia decaocto), cerdo asilvestrado (Sus scrofa) y borrego berberisco (Ammotragus lervia) en Áreas Naturales Protegidas del noreste de México, con el fin de identificar zonas de alto riesgo de invasión y contribuir al diseño de estrategias preventivas de manejo y conservación. A partir de la modelación del nicho ecológico de estas especies mediante el programa MaxEnt, se obtuvieron las áreas de distribución geográficas potenciales para dichas especies y se delimitaron las zonas de mayor riesgo en las ANP. Se identificó que la distribución potencial de las tres especies abarca aproximadamente el 44 % de la superficie de estas zonas de conservación; las áreas con mayor vulnerabilidad corresponden a Maderas del Carmen, Ocampo y Cumbres de Monterrey. Los modelos obtenidos indican un aumento en la distribución bajo el escenario climático futuro de A. lervia y S. scrofa domesticus, mientras que la distribución de S. decaocto presenta una ligera disminución. Este estudio sugiere la implementación de una estrategia regional de monitoreo y vigilancia sobre especies exóticas invasoras para tomar acciones de manejo que interrumpan la dispersión de dichas especies, así como su impacto sobre la flora y la fauna silvestre en el noreste de México.
Palabras clave: Áreas Naturales Protegidas, conservación, especies exóticas invasoras, noreste mexicano, nicho ecológico, modelación.
Climatic Suitability of Three Invasive Vertebrate Species in Protected Natural Areas of Northeastern Mexico
Abstract. Protected Natural Areas (PNAs) are essential for biodiversity conservation, but they face multiple threats, particularly biological invasions driven by ongoing, intense human activities. The northeastern region of Mexico, covering Coahuila, Nuevo León, and Tamaulipas, has high biodiversity and endemism, with more than 80 PNAs. However, this region has recently recorded the presence of invasive exotic species (IES) with strong potential for spread. This paper analyzes biological invasions by assessing the current and future climatic suitability of three invasive exotic species: collared dove (Streptopelia decaocto), feral pig (Sus scrofa), and Barbary sheep (Ammotragus lervia) in PNAs of northeastern Mexico. The goal is to identify high-risk invasion areas and to inform the design of preventive management and conservation strategies. Using the MaxEnt program to model the ecological niche of these species, potential geographic distribution areas were identified, and the highest-risk zones within the PNAs were outlined. The potential distribution of the three species was estimated to cover approximately 44% of the area of these conservation zones; the most vulnerable areas are Maderas del Carmen, Ocampo, and Cumbres de Monterrey. The obtained models indicate an increased distribution of A. lervia and S. scrofa domesticus under the future climate scenario, whereas the distribution of S. decaocto shows a slight decrease. This study recommends the regional implementation of a monitoring and surveillance strategy for invasive exotic species to guide management actions that interrupt their dispersal and reduce their impacts on native flora and fauna in northeastern Mexico.
Keywords: Protected Natural Areas, conservation, invasive exotic species, northeastern Mexico, ecological niche, modeling.
Idoneidade climática de três espécies de vertebrados invasores em Áreas Naturais Protegidas no nordeste do México
Resumo. As Áreas Naturais Protegidas (ANPs) são pilares fundamentais para a conservação da biodiversidade, mas são vulneráveis a múltiplas pressões e, em particular, a invasões biológicas devido às atividades humanas constantes e intensas. A região nordeste do México, que inclui Coahuila, Nuevo León e Tamaulipas, apresenta alta biodiversidade e elevado endemismo, com mais de 80 ANPs. No entanto, nos últimos anos, registrou-se a presença de espécies exóticas invasoras (EEI) com alto potencial de disseminação nessa região. Neste artigo, apresenta-se uma análise das invasões biológicas por meio da avaliação da idoneidade climática atual e futura de três EEI: o pombo-de-colar-turco (Streptopelia decaocto), o porco-asselvajado (Sus scrofa) e o carneiro-da-barbária (Ammotragus lervia) em ANPs do nordeste do México, com o objetivo de identificar áreas de alto risco de invasão e contribuir para o desenho de estratégias preventivas de manejo e conservação. A partir da modelagem do nicho ecológico dessas espécies pelo programa MaxEnt, obtiveram-se as áreas potenciais de distribuição geográfica para essas espécies e delimitaram-se as zonas de maior risco nas ANPs. Identificou-se que a distribuição potencial das três espécies abrange aproximadamente 44% da superfície dessas zonas de conservação; as áreas de maior vulnerabilidade correspondem a Maderas del Carmen, Ocampo e Cumbres de Monterrey. Os modelos obtidos indicam um aumento na distribuição sob o cenário climático futuro para A. lervia e S. scrofa domesticus, enquanto a distribuição de S. decaocto apresenta uma leve diminuição. Este estudo sugere a implementação de uma estratégia regional de monitoramento e vigilância de espécies exóticas invasoras para empreender ações de manejo que interrompam a dispersão dessas espécies e mitiguem seu impacto sobre a flora e a fauna silvestres no nordeste do México.
Palavras-chave: Áreas Naturais Protegidas, conservação, espécies exóticas invasoras, nordeste mexicano, nicho ecológico, modelagem.
Introducción
La humanidad enfrenta actualmente una de las crisis ambientales más severas, derivada del impacto acumulativo y sinérgico de las actividades antropogénicas sobre los ecosistemas, los servicios ambientales que proveen y la biodiversidad que sustentan. Entre las amenazas se encuentra la pérdida y fragmentación de los ecosistemas, la contaminación, el comercio ilegal, la introducción de especies invasoras y el cambio climático. Esta última amenaza tiene efectos que llegan a todo el planeta, lo que afecta a los ecosistemas naturales y pone en peligro la integridad de los procesos ecosistémicos y la biodiversidad misma (Habibullah et al., 2024; Shivanna, 2022). Ante los cambios ambientales de los últimos dos siglos, se han desarrollado diversas estrategias de conservación. Entre ellas, se destacan las Áreas Naturales Protegidas (ANP) como el principal mecanismo para preservar la integridad de los ecosistemas y proteger especies en peligro de extinción o con alguna otra categoría de riesgo. Estas áreas, establecidas por gobiernos o entidades privadas, han mostrado los mejores resultados de conservación y proporcionan hábitats para la flora y fauna silvestre (Pulido-Chadid et al., 2023).
La resiliencia de las ANP se manifiesta en la conservación de la diversidad genética y de especies, al actuar como bancos genéticos y refugios climáticos para especies que podrían enfrentar presiones ambientales en otras áreas (Selwood y Zimmer, 2020). Su capacidad como corredores ecológicos facilita la migración y dispersión de especies en respuesta al cambio climático, al reducir el aislamiento de poblaciones y aumentar la diversidad genética (Melillo et al., 2016; Taylor y Figgis, 2007; Thomas y Gillingham, 2015). Sin embargo, la creciente amenaza que representan las especies exóticas invasoras (EEI) alrededor del mundo (Carneiro et al., 2024; Carneiro et al., 2025) exige que las ANP desarrollen estrategias para su vigilancia y monitoreo, con la finalidad de asegurar su efectividad a largo plazo. Una estrategia clave para mitigar el potencial impacto de las EEI es identificar potenciales áreas de establecimiento y de riesgo. Sin embargo, la falta de financiamiento, el escaso interés por parte de las autoridades responsables y la vasta extensión de algunas ANP dificulta su manejo, por lo cual es relevante identificar áreas potenciales de establecimiento de las EEI para dirigir los esfuerzos de control (El-Barougy et al., 2021; Packer et al., 2017).
En México, las políticas nacionales en materia de ANP se sustentan en el marco legal de la Ley General del Equilibrio Ecológico y la Protección al Ambiente (LGEEPA), orientadas a la conservación de la biodiversidad y el mantenimiento de los servicios ecosistémicos. La Estrategia Nacional sobre Biodiversidad de México (Consejo Nacional para el Conocimiento y Uso de la Biodiversidad [CONABIO], 2016) establece lineamientos para integrar la biodiversidad en la toma de decisiones sectoriales y territoriales, al priorizar la conservación in situ a través del fortalecimiento de las ANP. De manera complementaria, la Estrategia Nacional para Prevenir, Controlar y Erradicar Especies Invasoras (Comité Asesor Nacional sobre Especies Invasoras, 2010) reconoce a las ANP como sitios críticos para la detección temprana y manejo de EEI, lo que promueve acciones coordinadas de prevención, control y restauración ecológica. Ambas estrategias convergen en un enfoque de manejo adaptativo, gobernanza participativa y conservación efectiva del patrimonio natural del país.
En este estudio se describe la problemática de las invasiones biológicas en las ANP, y se evalúa la idoneidad climática actual y futura de tres EEI: la paloma de collar turca (Streptopelia decaocto), el cerdo asilvestrado (Sus scrofa domesticus) y el borrego berberisco (Ammotragus lervia) en ANP del noreste de México, con el fin de identificar zonas de alto riesgo de invasión, comprender la relación entre las condiciones ambientales y el potencial invasivo de estas especies, así como evaluar los posibles cambios en su distribución derivados del cambio climático y contribuir al diseño de estrategias preventivas de manejo y conservación.
El artículo se organiza en cuatro secciones principales. La primera ofrece un contexto general sobre los factores que favorecen la introducción y proliferación de especies exóticas invasoras, acompañado de un marco teórico que aborda las especies analizadas, sus posibles impactos en la biota nativa y la relevancia de los modelos de distribución de especies como herramienta para predecir su expansión. Asimismo, se describe la problemática específica en la región de estudio. La segunda sección detalla el diseño metodológico, que incluye la recopilación de información, la integración de parámetros bioclimáticos y la modelación de la distribución actual y futura de las especies bajo escenarios de cambio climático. En la tercera sección, se presentan los resultados y su discusión, al destacar las implicaciones ecológicas de las especies invasoras en las Áreas Naturales Protegidas (ANP) de la región. Finalmente, en la cuarta sección, se exponen las conclusiones, que integran recomendaciones para el manejo, control y mitigación de los impactos de estas especies sobre la biodiversidad nativa. Se espera que los resultados de esta investigación proporcionen un diagnóstico sobre el papel de las EEI en el noreste de México, particularmente en las ANP, y que sirvan como base para el diseño de una estrategia regional de gestión alineada con las prioridades de investigación establecidas para el cumplimiento de la Agenda 2030, en especial con los Objetivos de Desarrollo Sostenible 13 (acción por el clima) y 15 (vida de ecosistemas terrestres) (Naciones Unidas, 2023). Este enfoque facilita la formulación de estrategias preventivas de manejo y conservación fundamentadas en escenarios futuros y refuerza la capacidad de respuesta frente a amenazas emergentes para la biodiversidad y los servicios ecosistémicos.
Factores determinantes en la introducción y proliferación de las especies invasoras
Una especie exótica invasora (EEI) es aquella que, tras ser introducida en un ecosistema ajeno, logra establecerse, reproducirse y dispersarse en los nuevos ambientes, favorecida por la ausencia de depredadores naturales o por condiciones ambientales propicias (Dueñas et al., 2021). Estas especies generan impactos negativos sobre la biodiversidad nativa y los ecosistemas. Las EEI constituyen una amenaza significativa para la integridad ecológica, ya que compiten y desplazan a especies de flora y fauna nativas por recursos, introducen nuevos depredadores y modifican la estructura comunitaria, lo que repercute en el funcionamiento ecosistémico (Carneiro et al., 2024, 2025). Los ecosistemas afectados pueden sufrir alteraciones en funciones clave como la polinización, la regulación climática, la purificación del agua y la protección contra la erosión del suelo (Burgiel y Muir, 2010; Gallardo et al., 2024). Asimismo, las EEI pueden representar riesgos para la salud humana y la fauna doméstica, al actuar como vectores de enfermedades y parásitos que facilitan la transmisión de agentes infecciosos —virus, bacterias y protozoarios— hacia la fauna nativa (Chinchio et al., 2020; Roy et al., 2017).
La presencia de EEI conlleva una percepción socioeconómica compleja y variada, influenciada por factores culturales, educativos, impactos ecológicos y económicos, y la interacción de estas especies con las comunidades locales (Kapitza et al., 2019; Shackleton et al., 2018). La valoración económica y recreativa, impulsada por el turismo y actividades afines, y la apreciación estética, generan una percepción social positiva. Incluso, algunas especies se integran a las costumbres y prácticas culturales (Hanley y Roberts, 2019). No obstante, la percepción social negativa se centra en la amenaza a la biodiversidad, los daños a la agricultura, pesca y ganadería, los altos costos de control y erradicación, y los problemas de salud pública.
En México, la presencia de EEI de S. decaocto, S. scrofa domesticus, y A. lervia representa un desafío creciente para la conservación de la biodiversidad (CONABIO, 2023; Ramírez-Albores y Badano, 2021), dado que, en los últimos años, se ha observado la presencia de estas especies dentro de ANP y en sus alrededores. S. decaocto, originaria de Eurasia, fue registrada por primera vez en México en la década de 1990 y actualmente se encuentra ampliamente distribuida en ambientes urbanos y periurbanos del país. Su rápida expansión se debe a su alta tolerancia a ambientes antrópicos, dieta generalista y comportamiento sinantrópico (Shao et al., 2024). Ammotragus lervia, mamífero nativo del norte de África introducido con fines cinegéticos en áreas desérticas y semidesérticas del norte de México (Álvarez-Romero et al., 2008), particularmente en Coahuila y Nuevo León, ha formado poblaciones silvestres autosustentables. Su capacidad de adaptación a condiciones áridas, la amplitud de su dieta y la ausencia de depredadores naturales han favorecido su naturalización y la competencia con especies nativas, como el borrego cimarrón (Ovis canadensis) (Gastelum-Mendoza et al., 2023; Rodríguez-García et al., 2023).
Por su parte, S. scrofa domesticus, introducido desde el periodo colonial y descendiente del jabalí euroasiático domesticado, ha dado lugar a poblaciones asilvestradas en varios continentes. Su elevada tasa reproductiva, comportamiento agresivo y uso eficiente de recursos le confieren una ventaja competitiva frente a la fauna nativa. Su expansión se ha intensificado por prácticas de manejo extensivo y abandono de animales en áreas rurales. Este taxón afecta negativamente la regeneración vegetal, dispersa especies exóticas y depreda fauna nativa, además de ser vector de enfermedades zoonóticas (Allen et al., 2021; Zanón-Martínez et al., 2016). Se ha documentado que S. scrofa domesticus amenaza a 672 taxones en 54 países en todo el mundo. La mayoría de ellos están clasificados como en peligro crítico o de extinción y 14 especies han desaparecido como resultado directo de los impactos de los cerdos asilvestrados (Risch et al., 2021). Por otra parte, en el ámbito económico, ha generado pérdidas significativas en cultivos de maíz, cereales y papas en Europa y Norteamérica, que ascienden a más de 80 millones de dólares anuales (Lombardini et al., 2017; Rekiel et al., 2024). En la tabla 1 se presenta una síntesis de las principales características de estas especies: origen biogeográfico, áreas de distribución natural, año y causas de introducción.
|
Especie |
Familia |
Origen biogeo- |
Ecosistemas en su área de distribución natural |
Año de |
Causas de introducción |
|
Paloma de collar turca (Streptopelia decaocto) |
Columbidae |
Asia meridional |
Bosques abiertos, matorrales, áreas agrícolas, zonas periurbanas y rurales |
2000 |
Mascota |
|
Cerdo |
Suidae |
Eurasia |
Bosques templados y tropicales, humedales, praderas y matorrales |
1988 |
Alimentación y aprovechamiento cinegético |
|
Borrego berberisco (Ammotragus lervia) |
Bovidae |
Norte de África |
Zonas montañosas áridas y semiáridas, matorrales desérticos y pastizales pedregosos |
~1960 |
Aprovechamiento cinegético |
Tabla 1. Síntesis de las especies invasoras de estudio en la región noreste de México. Fuente: modificado de Álvarez-Romero et al. (2008).
Los factores que agravan el éxito invasor de estas tres especies incluyen ausencia de control poblacional, perturbaciones antropogénicas y falta de depredadores. Estas especies generan impactos ecológicos significativos: S. decaocto desplaza aves nativas por competencia por sitios de anidación; A. lervia causa sobrepastoreo, erosión y competencia con mamíferos nativos; y S. scrofa domesticus afecta la regeneración vegetal, dispersa enfermedades y depreda nidos y fauna del suelo (Lombardini et al., 2017; Rekiel et al., 2024; Risch et al., 2021). Dada su expansión continua y sus efectos adversos, estas especies en México requieren atención prioritaria debido a sus impactos ecológicos, sanitarios y económicos, lo cual demanda acciones coordinadas de monitoreo, control y prevención. En la tabla 2 se presenta la influencia de estas especies en las interacciones ecológicas y humanas.
|
Especie |
Impactos ecológicos |
Impactos socioeconómicos |
Referencias |
|
|---|---|---|---|---|
|
Interacciones |
Especies afectadas |
|||
|
Paloma de collar turca (Streptopelia decaocto) |
(-) Competencia (recursos) (-) Vector de enfermedades (-) Composición |
Paloma ala blanca (Zenaida asiatica), paloma huilota (Z. macroura), paloma doméstica (Columba livia) y tortolita cola larga (Columbina inca) |
(-) Daños a la infraestructura (-) Cultivos (aunque poco significativa en las bodegas de granos) |
Álvarez-Romero et al. (2008) Koening (2020) Ludwick et al. (2023) Poling y Heyslette (2006) |
|
Cerdo asilvestrado (Sus scrofa domesticus) |
(-) Competencia (recursos) (-) Vector de enfermedades a fauna silvestre (+/-) Cadena trófica (-) Composición |
Venado cola blanca (Odocoileus virginianus), venado bura (O. hemionus), puma (Puma concolor), coyote (Canis latrans), zopilotes (Cathartes aura, Coragyps atratus), águila real (Aquila chrysaetus), zorra gris (Urocyon cinereoargenteus), pecarí de labios blancos (Tayassu pecari), pecarí de collar (Dicotyles tajacu), vegetación nativa |
(-) Daños a la infraestructura (-) Cultivos (maíz, cereales, papa) (-) Colisión con vehículo (+) Turismo y cacería cinegética (-) Vector de enfermedades a fauna doméstica e inclusive a la salud humana (-) Hibridación |
Allen et al. (2021) Álvarez-Romero et al. (2008) Anderson et al. (2016) Ballari y Barrios-García (2014) Bolds et al. (2021) McDonough et al. (2022), Pepin et al. (2016), Rekiel et al. (2024) Zanón-Martínez et al. (2016) |
|
Borrego berberisco (Ammotragus lervia) |
(-) Competencia (recursos) (-) Vector de enfermedades a fauna silvestre (+/-) Cadena trófica (-) Composición |
Borrego cimarrón (Ovis canadensis), venado cola blanca (Odocoileus virginianus), venado bura (O. hemionus), puma (Puma concolor), coyote (Canis latrans), zopilotes (Cathartes aura, Coragyps atratus), águila real (Aquila chrysaetus), vegetación nativa |
(-) Daños a la infraestructura (-) Cultivos (maíz, cereales, papa) (+) Turismo y cacería cinegética (-) Vector de enfermedades a fauna doméstica e inclusive a la salud humana (-) Hibridación |
Álvarez-Romero et al. (2008) Gastelum-Mendoza et al. (2023) Rodríguez-García et al. (2023) |
Tabla 2. Influencia de la paloma de collar turca, cerdo asilvestrado y borrego berberisco en las interacciones ecológicas y humanas. Entre paréntesis se encuentran los tipos de impactos, negativos (-) y/o positivos (+).
Los modelos de distribución de especies: una herramienta frente a las EEI
La identificación de áreas geográficas con condiciones ambientales favorables para el establecimiento de EEI es esencial para implementar medidas preventivas y definir prioridades de control y erradicación, según el riesgo de invasión (Sexton et al., 2009; Venette et al., 2021). Los modelos de distribución de especies, basados en el concepto de nicho ecológico, constituyen una herramienta clave en este proceso. Este concepto se clasifica en: fundamental, que abarca el conjunto completo de condiciones ambientales que permiten la supervivencia y reproducción de una especie en ausencia de interacciones bióticas limitantes; realizado, que corresponde a la porción del nicho fundamental efectivamente ocupada bajo la influencia de competencia, depredación y barreras de dispersión; y potencial, que representa áreas ambientalmente aptas considerando tolerancias fisiológicas y ciertas restricciones ecológicas (Soberón y Peterson, 2005).
La relevancia de estos modelos radica en su capacidad para proyectar escenarios presentes y futuros que identifican áreas idóneas para el establecimiento de EEI, a partir de las condiciones ambientales de los ecosistemas actualmente ocupados. Se fundamentan en la premisa de que cada especie presenta un rango óptimo de condiciones para su supervivencia y reproducción. Al extrapolar sus requerimientos climáticos a regiones no invadidas, es posible anticipar su expansión (Bellard et al., 2018; Petitpierre et al., 2012). Esta proyección se realiza mediante modelos de nicho ecológico, que correlacionan registros de presencia con variables ambientales (Guisan y Thuiller, 2005), lo que permite identificar áreas potencialmente aptas incluso fuera de su distribución natural (Finch et al., 2021; Kariyawasan et al., 2020).
La comprensión del conservadurismo de nicho en EEI es clave para estimar el riesgo de invasión mediante modelos de nicho ecológico. No obstante, este supuesto no siempre se cumple, ya que dichas especies pueden experimentar cambios en su nicho al ocupar nuevos ambientes climáticos en áreas introducidas, debido a la ausencia de competidores o depredadores, o bien a presiones selectivas que favorecen la adaptación local y la ampliación de tolerancias ambientales (Broennimann et al., 2007; Shea y Chesson, 2002; Wiens et al., 2010). Esto implica que extrapolar sus requerimientos climáticos desde áreas nativas puede subestimar su distribución potencial (Barbosa et al., 2012; Gallagher et al., 2010). La proyección de la distribución potencial bajo escenarios de cambio climático permite evaluar posibles desplazamientos en los rangos de distribución. Los algoritmos correlativos (por ejemplo, MaxEnt, BIOCLIM, GARP) modelan principalmente el nicho realizado, limitado por interacciones bióticas e historia evolutiva, mientras que los modelos mecanicistas (por ejemplo, NicheMapper) estiman el nicho fundamental al integrar parámetros fisiológicos y proporcionar estimaciones más amplias y realistas (Kearney y Porter, 2009). Sin embargo, los modelos de distribución de especies presentan limitaciones derivadas de datos incompletos, simplificación de procesos ecológicos y efectos antrópicos (D’Antonio et al., 2001; Sax et al., 2007).
En teoría, las EEI invaden únicamente regiones con condiciones compatibles con su nicho, y el clima constituye la principal barrera ambiental (Alexander y Edwards, 2010; Sax et al., 2007; Sexton et al., 2009). Anticipar estas áreas facilita la planificación proactiva, como la erradicación temprana o vigilancia intensiva. La temporalidad es un factor estratégico, ya que las fluctuaciones estacionales determinan la fenología, dispersión y vulnerabilidad de las EEI. Implementar medidas en periodos de baja actividad o etapas juveniles maximiza la eficiencia de los controles y minimiza impactos sobre especies nativas (Kettenring y Adams, 2011). Por tanto, integrar modelización, proyecciones climáticas y estacionalidad en las estrategias de manejo resulta fundamental para reducir los riesgos ecológicos y económicos, especialmente en las Áreas Naturales Protegidas (El-Barougy et al., 2021; Vicente et al., 2013).
¿Qué está pasando en las ANP del noreste de México?
De acuerdo con el Instituto Nacional de Estadística y Geografía [INEGI] (2022), la región noreste de México está conformada por los estados de Nuevo León, Coahuila y Tamaulipas. Es una zona con una gran biodiversidad, caracterizada por su alto índice de endemismos, particularmente en plantas (Luna et al., 2004). En dichos espacios predominan los siguientes tipos de vegetación: matorrales, bosques de coníferas, chaparrales y pastizales naturales (Villaseñor et al., 2023).
En materia de protección ambiental, la región noreste de México cuenta con más de 80 ANP a escala federal, estatal, municipal, ejidal y privada (Figura 1), distribuidas en Nuevo León (30), Coahuila (47) y Tamaulipas (11) y con una superficie de 41 656,4 km2 (CONANP, 2025). En los últimos años se ha documentado la presencia de S. decaocto, S. scrofa domesticus y A. lervia dentro de Áreas Naturales Protegidas y en sus zonas adyacentes. Esta situación probablemente se relaciona con introducciones accidentales o deliberadas, lo que evidencia la vulnerabilidad de estos espacios a la invasión biológica y la necesidad de fortalecer las estrategias de prevención, detección temprana y manejo para mitigar sus impactos sobre la biodiversidad nativa (Álvarez-Romero et al., 2008). A. lervia y S. scrofa domesticus deben su presencia a los ranchos cinegéticos, y estos además representan un riesgo significativo para las ANP adyacentes, por ser focos de propagación. La cercanía espacial de estos ranchos facilita el escape, dispersión intencional o accidental de individuos hacia hábitats naturales, donde pueden establecerse, reproducirse y competir con especies nativas (Schwoerer et al., 2024).
Además, los límites de las ANP no impiden el movimiento de fauna, lo que permite la conectividad ecológica entre paisajes modificados y áreas conservadas. Esta conectividad facilita el ingreso de EEI y compromete el cumplimiento de los objetivos de conservación. Por tanto, la ubicación y manejo de ranchos cinegéticos deben considerarse dentro de estrategias integrales de bioseguridad, especialmente en regiones con alta biodiversidad y valor ecológico.
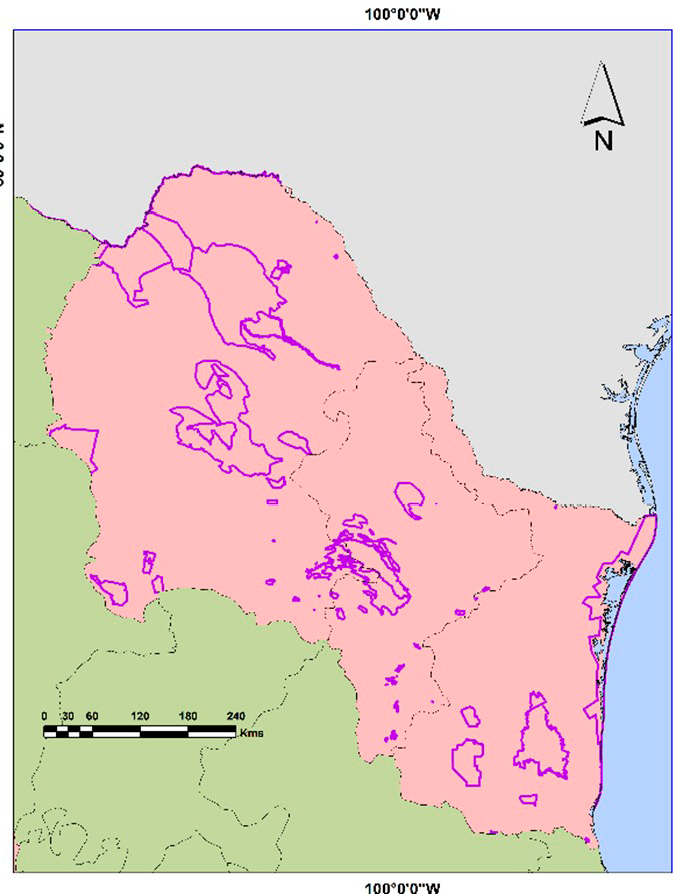
Figura 1. Ubicación de la región noreste de México, y de las ANP localizadas en esta región. Los polígonos de color morado representan las ANP en la región. Fuente: elaboración propia con datos de la CONANP (2025).
Metodología
Se elaboró una base de registros de presencia para las tres EEI, al descargar información de la plataforma Global Biodiversity Information Facility (GBIF) entre septiembre de 2023 y junio de 2024, y se complementó la base de registros con datos de literatura científica e información recabada en campo. El conjunto de datos fue depurado para minimizar sesgos de muestreo y evitar el sobreajuste del modelo. Se eliminaron los registros duplicados, aquellos que carecían de coordenadas precisas y los ubicados a menos de 3 km entre sí, lo que aseguró la independencia espacial mediante el uso del paquete spThin (Aiello-Lammens et al., 2015) en el software estadístico R (versión 4.1.2; R Core Team, 2021). Asimismo, se aplicó un filtro de heterogeneidad ambiental en ArcMap 10.2 SDMtoolbox (Environmental Systems Research Institute [ESRI], 2014) para excluir registros asociados a valores climáticos erróneos (Brown, 2014).
Por otro lado, las variables predictoras se seleccionaron a partir de los 19 parámetros bioclimáticos de WorldClim 2.1 (~1 km² de resolución; periodo 1970-2000) (Fick y Hijmans, 2017), representativos de la temperatura y la precipitación. Para reducir colinealidad y sobreajuste, se retuvieron únicamente variables no redundantes con coeficiente de correlación de Pearson (r) ≤ 0,80 y factor de inflación de varianza ≤ 10 (Cobos et al., 2019; Naimi, 2015; Naimi y Araujo, 2016), obteniendo en promedio ocho variables por especie (Tabla 3). Las proyecciones climáticas futuras (año 2050) se obtuvieron del Sexto Informe de Evaluación del Panel Intergubernamental del Cambio Climático (IPCC, 2021), seleccionando los modelos MIROC6 e IPSL-CM6A-LR bajo el escenario más pesimista de Trayectoria Socioeconómica Compartida (SSP585) del CMIP6 (Eyring et al., 2016; Tebaldi et al., 2021), como insumo para evaluar impactos y riesgos del cambio climático (Pirani et al., 2024). Este trabajo consideró solamente el escenario más drástico y pesimista (Pirani et al., 2024; Tebaldi et al., 2021), dado que se estima un incremento de 2 °C en la temperatura promedio en una proyección de cambio climático a mediano plazo (periodo 2041-2060) de acuerdo con el IPCC (2021).
|
Variable bioclimática |
Streptopelia decaocto (% contribución) |
Sus scrofa domesticus (% contribución) |
Ammotragus lervia (% contribución) |
|
Intervalo medio diurno (Bio2) |
37,3 |
3,7 |
|
|
Isotermalidad (Bio3) |
11,4 |
55,8 |
|
|
Estacionalidad de la temperatura (Bio4) |
3,0 |
||
|
Temperatura mínima del mes más frío (Bio6) |
14,1 |
2,9 |
16,5 |
|
Intervalo de temperatura anual (Bio7) |
4,2 |
21,7 |
|
|
Temperatura media del cuarto anual más cálido (Bio10) |
10,4 |
3,1 |
14,5 |
|
Precipitación anual (Bio12) |
13,3 |
8,7 |
|
|
Precipitación del mes más seco (Bio14) |
6,9 |
5,1 |
|
|
Temporalidad de la precipitación (Bio15) |
6,4 |
7,5 |
24,2 |
|
Precipitación del cuarto anual más húmedo (Bio16) |
6,0 |
||
|
Precipitación del cuarto anual más seco (Bio17) |
0,3 |
23 |
Tabla 3. Variables bioclimáticas consideradas para las especies invasoras de estudio en la región noreste de México. Fuente: WorldClim 2.1 (~1 km² de resolución; periodo 1970-2000) Fuente: adaptado de Fick y Hijmans (2017).
Los modelos de nicho ecológico se generaron con MaxEnt v.3.4.1 en R (R Core Team, 2021), que aplica el principio de máxima entropía para estimar la idoneidad de hábitat a partir de datos de presencia y variables ambientales (Elith et al., 2011; Phillips et al., 2006 y 2017). MaxEnt es un software utilizado en la modelación del nicho ecológico de especies invasoras (Sutton y Martin, 2022; Yiwen et al., 2016). Si bien, es ampliamente utilizado por su eficacia con datos de solo presencia, este método asume que las especies están en equilibrio con su entorno y que los registros son representativos, lo que puede no cumplirse en regiones con información limitada (Elith et al., 2011; Phillips et al., 2006 y 2017). Su enfoque estadístico basado en la teoría de máxima entropía permite generar predicciones robustas a partir de conjuntos de datos incompletos, al mantener un buen desempeño con muestras pequeñas y reducir sesgos asociados a la distribución del esfuerzo de muestreo. Además, ofrece interpretaciones claras de la contribución de cada variable ambiental, al facilitar la identificación de factores clave que favorecen la invasión.
La calibración y selección óptima de parámetros se realizó con el paquete kuenm (Cobos et al., 2019) en R (R Core Team, 2021), mediante la evaluación de 44 configuraciones candidatas por especie. Estas configuraciones incluyeron la combinación de cuatro conjuntos de variables y 17 multiplicadores de regularización (0,5-8,0) con distintos tipos de características (lineal, cuadrática, producto y umbral) (Phillips et al., 2017). La selección de modelos se basó en un error de omisión < 0,05 y valores mínimos del criterio de información de Akaike (Brewer et al., 2016; Merow et al., 2014; Warren y Seifert, 2011). El rendimiento se evaluó mediante error de omisión, el área bajo la curva (AUC), prueba ROC parcial y estadística de habilidad verdadera (True Skill Statistic o TSS, por sus siglas en inglés) (Allouche et al., 2006; Elith et al., 2006; Peterson et al., 2008). Los modelos se entrenaron con el 70 % de los datos y se validaron con el 30 % restante. Se generaron 100 réplicas para reducir la incertidumbre y se evaluó la transferibilidad con datos independientes.
Los modelos finales se proyectaron a escenarios climáticos futuros (Yates et al., 2018; Wenger y Olden, 2012) mediante extrapolación sin restricciones y extrapolación por fijación, con el fin de equilibrar la capacidad predictiva y evitar al máximo proyecciones irreales. Los mapas continuos de idoneidad (0-1) se transformaron en mapas binarios mediante un umbral que permitió la omisión del 10 % de los registros de entrenamiento, lo que minimizó los falsos positivos y permitió obtener estimaciones conservadoras de distribución potencial (Elith et al., 2011; Merow et al., 2014). Finalmente, se generaron mapas de idoneidad de hábitat potencial mediante el paquete raster (Hijmans, 2021) en R (R Core Team, 2021). Los mapas de probabilidad continua (0-1) se transformaron en mapas binarios de presencia-ausencia mediante un umbral que facilitó una omisión del 10 % de los registros de ocurrencia de entrenamiento, lo que corresponde a una tasa de falsos negativos del 5 %. Este enfoque minimizó los errores de comisión (falsos positivos), para producir así estimaciones más conservadoras de las distribuciones de las especies (Liu et al., 2014).
Resultados y discusión
Los modelos de distribución obtenidos evidencian que S. decaocto podría disminuir su rango de distribución dentro de las ANP bajo escenarios futuros, mientras que S. scrofa domesticus y A. lervia expandirían significativamente su rango dentro de estas áreas. Estos cambios incrementan la presión sobre especies nativas y procesos ecosistémicos, lo que compromete la eficacia de estrategias de conservación y resalta la necesidad urgente de acciones preventivas y manejo focalizado para mitigar los impactos de las EEI.
Implicaciones de las EEI dentro de las ANP del noreste de México
Los registros de presencia para S. decaocto se concentraron principalmente en centros urbanos y pequeños poblados. El modelo de nicho ecológico presente indica que el área potencial cubre el 205 356,4 km2 (69 %) de la superficie total de la región y 19 591,2 km2 (47 %) de la superficie de las ANP de la zona. Las áreas de mayor riesgo son Don Martín, Cumbres de Monterrey, Sierra de Zapalinamé, Sierra de Tamaulipas y Bajo Río San Juan (Figura 2). Bajo escenario de cambio climático (para el periodo 2041-2060), se predice que la distribución potencial se reducirá un 51 % (151 603 km2) del área total de la región y un 38,6 % (16 072,6 km2) de la superficie en las ANP (Figura 3), y en este caso las de más alto riesgo son Don Martín, Ocampo, Maderas del Carmen y Sierra de Tamaulipas. Se estima una disminución en la superficie de más del 18 % en la región y del 8 % dentro de las ANP. Estos cambios se concentran en la mayor parte oeste y centro de Coahuila y en algunas serranías en Nuevo León y Tamaulipas.
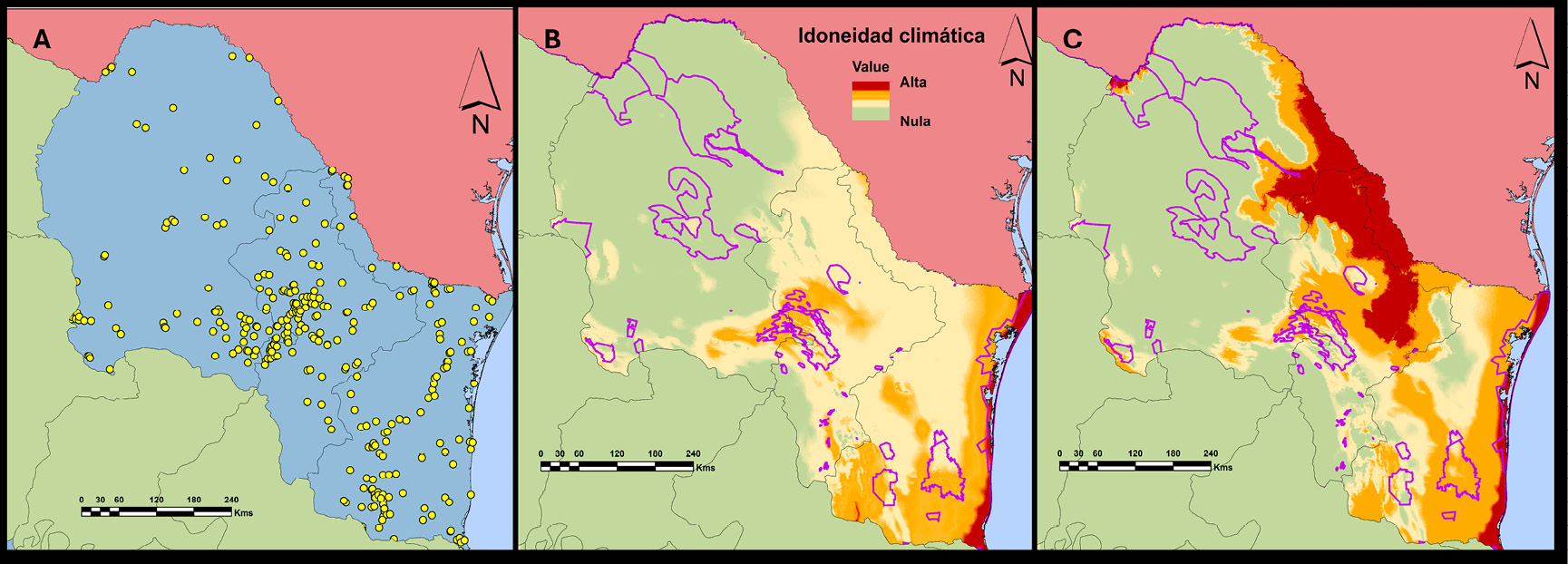
Figura 2. Registros de presencia de la paloma de collar turca (Streptopelia decaocto) (A), distribución potencial de la idoneidad climática estimada en la actualidad (B) y proyección de la distribución potencial para la especie para el periodo 2041-2060 (C). Los polígonos de color morado representan las ANP en la región. Fuente: elaboración propia con datos de registro de GBIF y datos de campo.
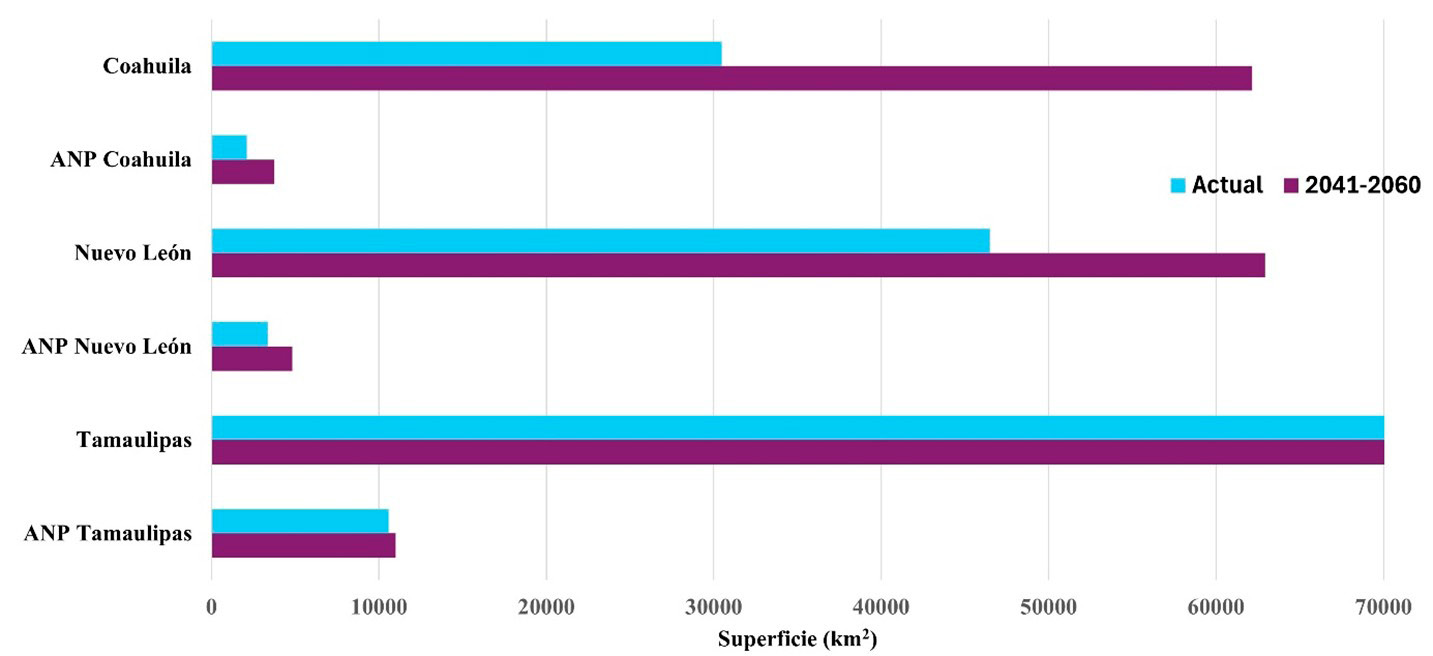
Figura 3. Variación de la superficie de distribución potencial de la paloma de collar turca (Streptopelia decaocto) actual y para el periodo 2041-2060 en la región noreste y dentro de las ANP. Fuente: elaboración propia.
Los registros de presencia para S. scrofa domesticus se concentraron principalmente en el norte de Coahuila, norte y este de Nuevo León y noroeste de Tamaulipas, principalmente en zonas donde se ubican ranchos con aprovechamiento cinegético (Figura 4). El modelo de nicho ecológico muestra que la distribución potencial cubre 132 638,2 km2 (45 % de la superficie total de la región) y 15 125,6 km2 (36 % de la superficie de las ANP de la región). Las que tienen un riesgo mayor son Don Martín y Cumbres de Monterrey (Figura 4). Bajo el escenario climático (para el periodo 2041-2060), se proyecta un incremento en la distribución potencial regional de 163 807 km2 (55,4 %) y 17 742,6 km2 (42,6 % dentro de las ANP). Las áreas de mayor riesgo son Don Martín y Cumbres de Monterrey (Figura 5). Se estima un aumento en la superficie de más del 10 % en la región y del 6 % dentro de las ANP. Este aumento en la distribución geográfica se centró hacia la parte centro y sur de los estados de Nuevo León y Tamaulipas.
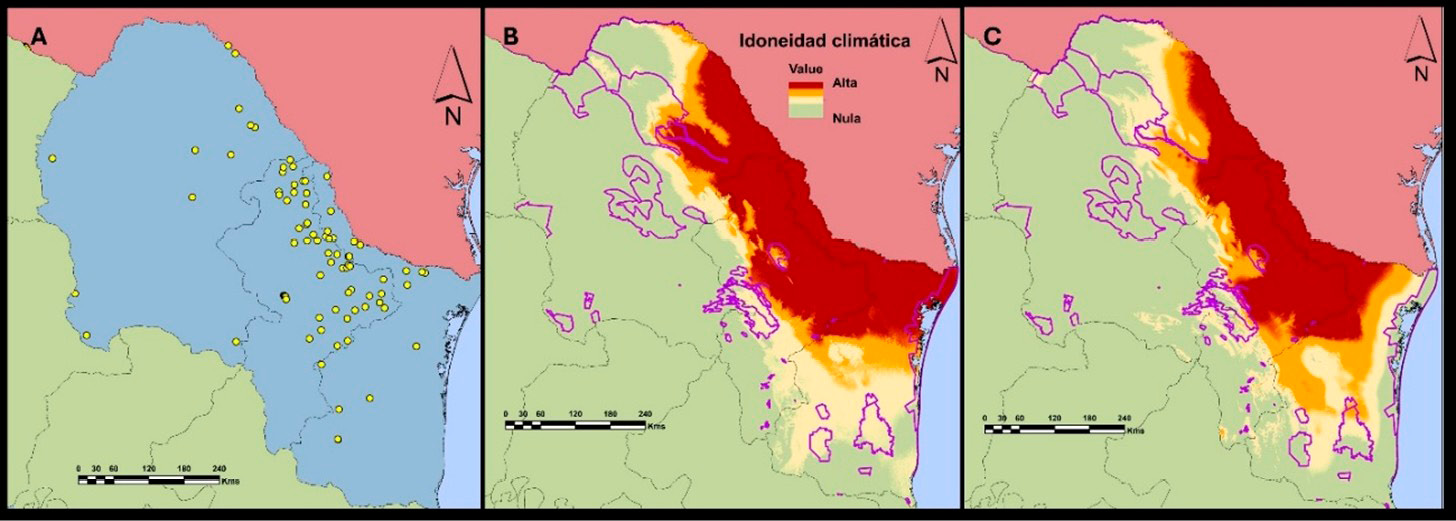
Figura 4. Registros de presencia del cerdo asilvestrado (Sus scrofa domesticus) (A), distribución potencial de la idoneidad climática estimada en la actualidad (B) y proyección de la distribución potencial para la especie para el periodo 2041-2060 (C). Los polígonos de color morado representan las ANP en la región. Fuente: elaboración propia con datos de registro de GBIF y datos de campo.
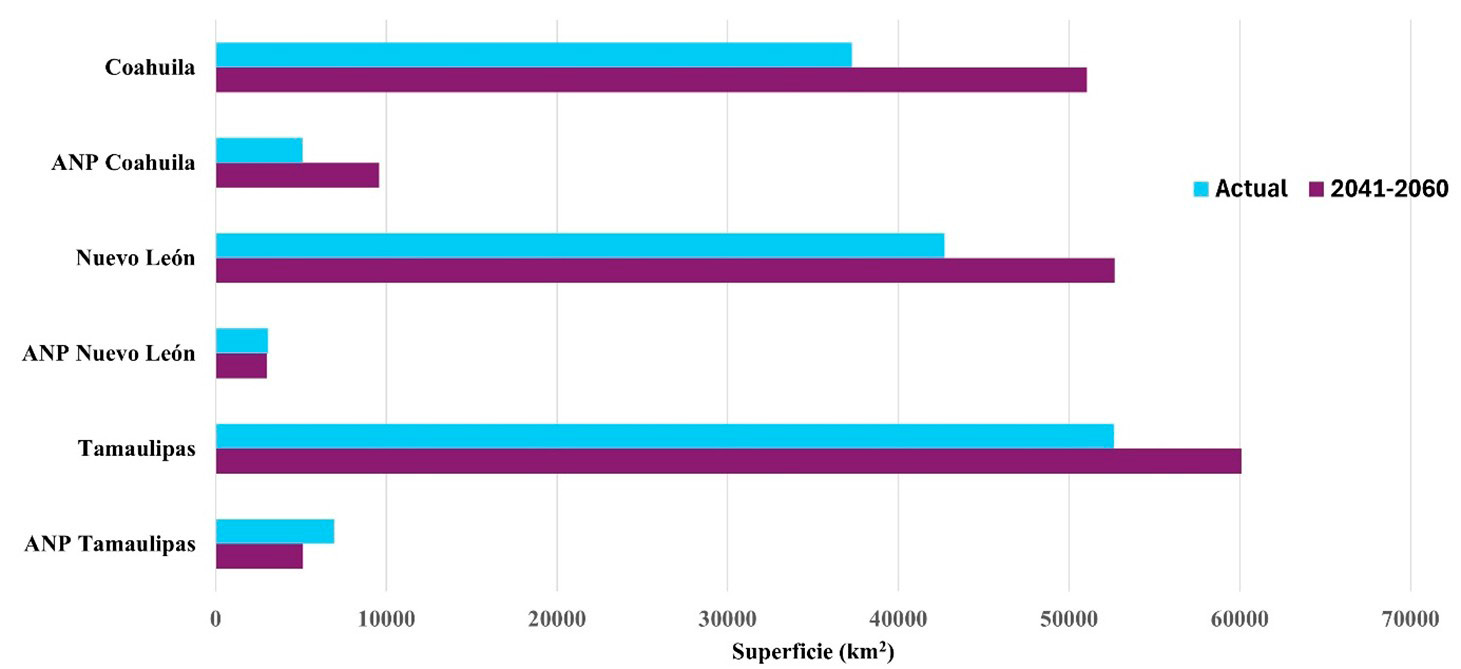
Figura 5. Variación de la superficie de distribución potencial del cerdo asilvestrado (Sus scrofa domesticus) actual y para el periodo 2041-2060 en la región noreste y dentro de las ANP. Fuente: elaboración propia.
Los registros de presencia para A. lervia se concentraron en el norte de Coahuila y esta abarca las ANP como Maderas del Carmen y Ocampo en el noreste de Coahuila, Nuevo León y Tamaulipas (Figura 6). El modelo de nicho ecológico indica que la distribución potencial abarca una superficie de 176 419 km2 (59,6 % de la superficie total de la región) y 20 987 km2 (50,4 % de la superficie de las ANP). En este caso, las ANP de mayor riesgo son Don Martín, Maderas del Carmen y Ocampo (Figura 6). Bajo escenario climático (para el periodo 2041-2060), se predice que la distribución potencial aumentará a 220 832 km2 (74,6 % a nivel regional) y 26 813,3 km2 (64,3 % estará en las ANP). En este escenario, las áreas de mayor riesgo son Don Martín, Ocampo, Maderas del Carmen, Villa de Bilbao y Sierra Picachos (Figura 7). Se estimó un aumento de más del 15 % a nivel regional y del 14 % dentro de las ANP. Estos cambios se presentaron principalmente en la mayor parte de Coahuila y Nuevo León, y en el noroeste de Tamaulipas.
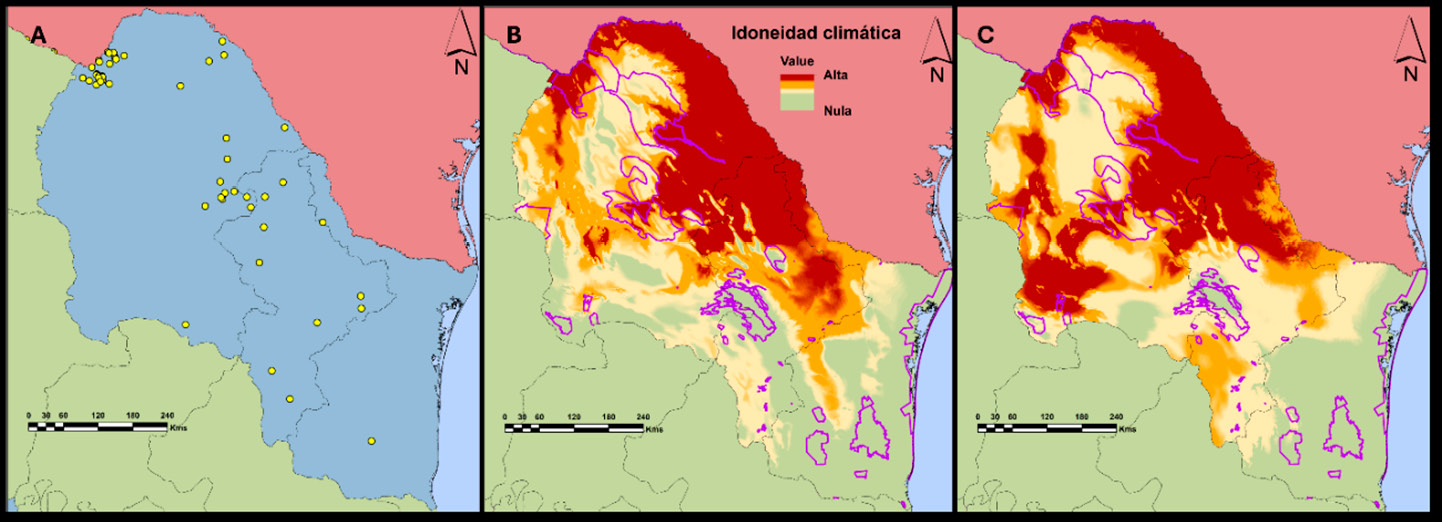
Figura 6. Registros de presencia del borrego berberisco (Ammotragus lervia) (A), distribución potencial de la idoneidad climática estimada en la actualidad (B) y proyección de la distribución potencial para la especie para el periodo 2041-2060 (C). Los polígonos de color morado representan las ANP en la región. Fuente: elaboración propia con datos de registro de GBIF y datos de campo.
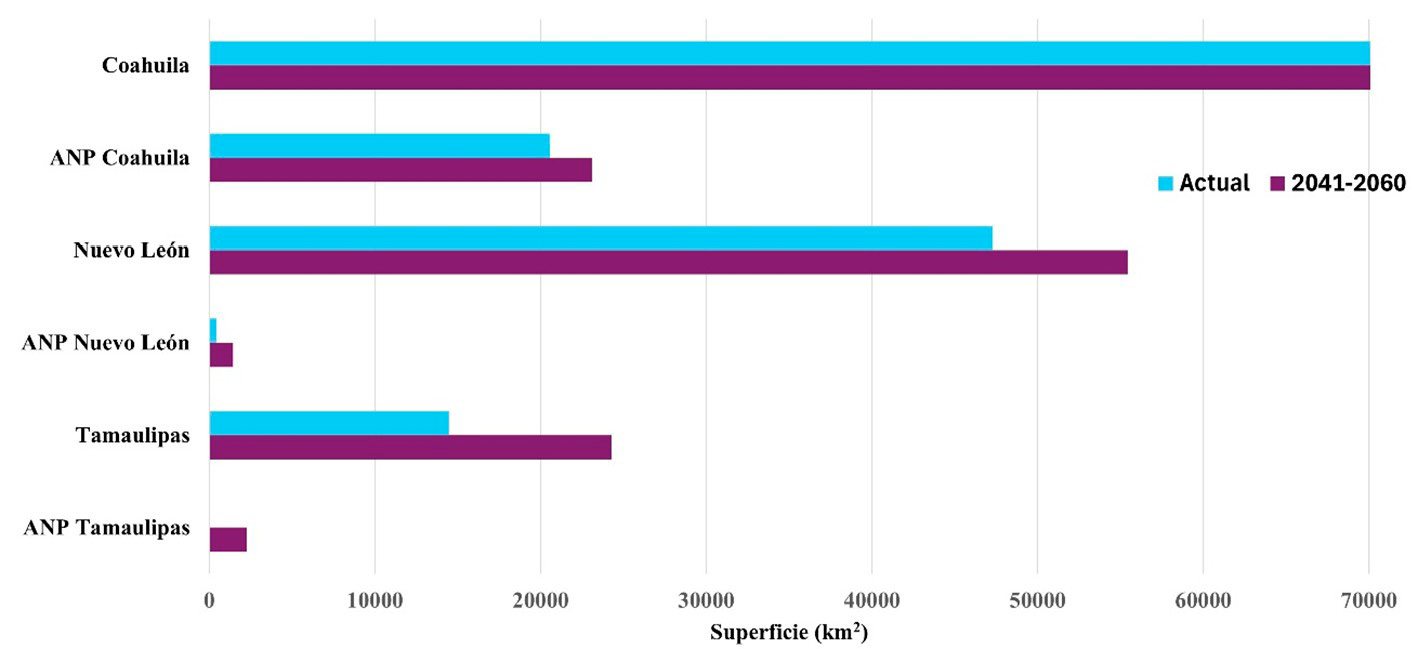
Figura 7. Variación de la superficie de distribución potencial del borrego berberisco (Ammotragus lervia) actual y para el periodo 2041-2060 en la región noreste y dentro de las ANP. Fuente: elaboración propia.
Los resultados preliminares de este estudio indican que la presencia de estas tres EEI potencialmente en las ANP podría afectar a diversos grupos taxonómicos nativos. Por ejemplo, S. decaocto puede competir por recursos con aves granívoras y frugívoras nativas, alterando la composición y dinámica de comunidades aviares. Ammotragus lervia representa una amenaza para ungulados silvestres como Odocoileus virginianus y Ovis canadensis en cuanto a competencia por forraje y degradación de hábitats. S. scrofa domesticus impacta negativamente a mamíferos, reptiles, anfibios y plantas mediante depredación directa, perturbación del suelo y destrucción de vegetación, además de favorecer procesos de erosión y modificar la estructura del ecosistema. Estos efectos pueden comprometer la integridad ecológica y la viabilidad de poblaciones nativas (Tabla 2). Los modelos elaborados indican un aumento en la distribución bajo el escenario climático futuro del cerdo asilvestrado y del borrego berberisco (Figuras 4-7); mientras que la distribución de la paloma de collar presenta una ligera disminución (Figuras 2 y 3). La disminución de la idoneidad climática para S. decaocto en las ANP del noreste de México podría limitar su capacidad de establecimiento y expansión, al reducir el riesgo de impactos ecológicos asociados a su presencia. En contraste, el incremento de la idoneidad climática para A. lervia y S. scrofa domesticus favorecería su potencial de invasión y persistencia, lo que incrementa la probabilidad de interacciones negativas con especies nativas, alteraciones en la estructura y funcionamiento de los ecosistemas, y mayores desafíos para las estrategias de manejo y control en dichos territorios protegidos.
La dispersión de especies invasoras en ambientes naturales representa una grave amenaza para la vida silvestre. Lo anterior aumenta la presión de depredación, el riesgo de enfermedades y altera el equilibrio ecológico dentro de los ecosistemas (Gutiérrez-Zapata et al., 2024; Orozco et al., 2022). Sin embargo, se debe de considerar la percepción local hacia estas especies y que varía según su valor de uso, el impacto en actividades productivas y el conocimiento sobre sus efectos ecológicos. Algunas poblaciones las valoran o aprovechan como recurso cinegético o alimenticio, mientras que otras las perciben negativamente por los daños que generan a cultivos, ganado o ecosistemas, o bien muestran indiferencia ante su presencia. Sin embargo, cambios en su distribución geográfica derivados de variaciones ambientales podrían modificar esta percepción, y esto intensifica o reduce su relevancia social y económica, especialmente si inciden de forma directa en la productividad local (Hanley y Roberts, 2019; Kapitza et al., 2019).
Por otro lado, la problemática presente en las ANP puede comprometer significativamente la eficacia de las iniciativas de conservación y amenazar el funcionamiento a largo plazo de los ecosistemas. Los estudios más recientes señalan que en ausencia de acciones de control, las áreas de distribución de varias EEI aumentarán bajo los diferentes escenarios climáticos (Barbet-Massin et al., 2018; El-Barougy et al., 2021; Ramírez-Albores et al., 2024). Por lo tanto, ante la detección temprana de S. decaocto, A. lervia y S. scrofa domesticus en ANP, es posible implementar medidas de control preventivas y de manejo focalizado. Los ENM pueden emplearse para identificar zonas con mayor riesgo de invasión y establecer puntos de monitoreo dirigidos, al optimizar la vigilancia y la asignación de recursos. Asimismo, se pueden aplicar restricciones al tránsito o dispersión de estas especies hacia áreas con alto potencial de invasión, mediante barreras físicas, control de accesos o regulaciones específicas. En casos de detección oportuna, las acciones pueden incluir captura selectiva, erradicación localizada o programas de control poblacional, y se priorizan los métodos que minimicen impactos en especies nativas y en el funcionamiento del ecosistema (Ahmad et al., 2019; El-Barougy et al., 2021; Ramírez-Albores et al., 2024).
En consecuencia, el abordaje de este problema debe realizarse de una manera coordinada con los tres niveles de gobierno, a través de una agenda de transversalidad entre las secretarias, la CONANP, y con los diferentes actores locales para el desarrollo de acciones concretas a corto, mediano y largo plazo, que garantice la erradicación o control de las EEI sobre el territorio nacional y con ello contribuir a la conservación de la biodiversidad.
Conclusiones
Las ANP son la piedra angular para la de la biodiversidad y la protección de los ecosistemas naturales; sin embargo, hoy en día enfrentan un problema mayor: la presencia de EEI. Los resultados indican que S. decaocto presenta actualmente amplia distribución potencial en la región y en diversas ANP, aunque se proyecta una reducción bajo escenarios climáticos conservación futuros, lo que disminuiría parcialmente su riesgo de expansión. En contraste, S. scrofa domesticus y A. lervia muestran incrementos significativos en su área potencial futura, tanto a nivel regional como dentro de ANP, con riesgos elevados en sitios como Don Martín, Cumbres de Monterrey, Maderas del Carmen y Ocampo. Estos aumentos implican mayor presión sobre ecosistemas, con posibles impactos en redes tróficas, incremento en la depredación, propagación de enfermedades y alteración de procesos ecológicos. La creciente vulnerabilidad de las ANP frente a las EEI constituye una amenaza directa para la conservación de la biodiversidad y el funcionamiento de los ecosistemas, lo que puede comprometer la efectividad de las estrategias de manejo. El estudio resalta que la percepción social hacia estas especies es variable y depende de su valor de uso o del impacto en actividades productivas, lo cual puede cambiar con modificaciones en su distribución geográfica.
Ante este escenario, la detección temprana y la aplicación de modelos de nicho ecológico permiten priorizar zonas de riesgo, optimizar recursos y diseñar acciones preventivas como monitoreo focalizado, control de accesos, barreras físicas, captura selectiva y erradicación localizada, coordinadas entre autoridades y actores locales para mitigar su impacto y preservar la biodiversidad. El manejo de EEI es un desafío que requiere un enfoque integrado que considere no solo los impactos ecológicos, sino también las consecuencias socioeconómicas. Entre las estrategias propuestas, se incluye acciones educativas y la sensibilización de la sociedad pública, ya que juegan un papel crucial en la conservación de la flora y fauna silvestre de la región.
Referencias
Ahmad, R., Khuroo, A.A., Charles, B., Hamid, M., Rashid, I. y Aravind, N.A. (2019). Global distribution modelling, invasion risk assessment and niche dynamics of Leucanthemum vulgare (Ox-eye Daisy) under climate change. Scientific Reports, 9, 11395. https://doi.org/10.1038/s41598-019-47859-1
Aiello-Lammens, M.E., Boria, R.A., Radosavljevic, A., Vilela, B. y Anderson, R.P. (2015). spThin: an R package for spatial thinning of species occurrence records for use in ecological niche models. Ecography, 38, 541-545. https://doi.org/10.1111/ecog.01132
Alexander, J.M. y Edwards P.J. (2010). Limits to the niche and range margins of alien species. Oikos, 119(9), 1377–1386. https://doi.org/10.1111/j.1600-0706.2009.17977.x
Allen, M.L., Elbroch, L.M. y Wittmer, H.U. (2021). Can’t bear the competition: Energetic losses from kleptoparasitism by a dominant scavenger may alter foraging behaviors of an apex predator. Basic and Applied Ecology, 51, 1–10. https://doi.org/10.1016/j.baae.2021.01.011
Allouche, O., Tsoar, A. y Kadmon, R. (2006). Assessing the accuracy of species distribution models: Prevalence, kappa and the true skill statistic (TSS). Journal of Applied Ecology, 43, 1223–1232. https://doi.org/10.1111/j.1365-2664.2006.01214.x
Álvarez-Romero, J.G., Medellín, R.A., Oliveras de Ita, A., Gómez de Silva, H. y Sánchez, O. (٢٠٠٨). Animales Exóticos en México: Una Amenaza para la Biodiversidad. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Instituto de Ecología-UNAM, Secretaria de Medio Ambiente y Recursos Naturales, México.
Anderson, A., Slootmaker, C., Harper, E., Holderieath, J. y Shwiff, S.A. (2016). Economic estimates of feral swine damage and control in 11 US states. Crop Protection, 89, 89–94. https://doi.org/10.1016/j.cropro.2016.06.023
Ballari, S.A. y Barrios-García, M.N. (2014). A review of wild boar Sus scrofa diet and factors affecting food selection in native and introduced ranges. Mammal Review, 44, 124–134. https://doi.org/10.1111/mam.12015
Barbet-Massin, M., Rome, Q., Villemant, C. y Courchamp, F. (2018). Can species distribution models really predict the expansion of invasive species? PLoS One, 13(3), e0193085. https://doi.org/10.1371/journal.pone.0193085
Barbosa, F.G., Schneck, F. y Melo, A.S. (2012). Use of ecological niche models to predict the distribution of invasive species: a scientometric analysis. Brazilian Journal of Biology, 72, 821–829. https://doi.org/10.1590/S1519-69842012000500007
Bellard, C., Jeschke, J.M., Leroy, B. y Mace, G.M. (2018). Insights from modeling studies on how climate change affects invasive alien species geography. Ecology and Evolution, 8, 5688-5700. https://doi.org/10.1002/ece3.4098
Bolds, S.A., Lockaby, B.G., Ditchkoff, S.S., Smith, M.D. y VerCauteren, K.C. (2021). Impacts of a large invasive mammal on water quality in riparian ecosystems. Journal of Environmental Quality, 50, 441–453. https://doi.org/10.1002/jeq2.20194
Brewer, M.J., Butler, A. y Cooksley, S.L. (2016). The relative performance of AIC, AICC and BIC in the presence of unobserved heterogeneity. Methods in Ecology and Evolution, 7, 679–692. https://doi.org/10.1111/2041-210X.12541
Broennimann, O., Treier, U.A., Muller-Scharer, H., Thuiller, W., Peterson, A.T. y Guisan, A. (2007). Evidence of climatic niche shift during biological invasion. Ecology Letters, 10, 701–709. https://doi.org/10.1111/j.1461-0248.2007.01060.x
Brown, J.L. (2014). SDM toolbox: A python-based GIS toolkit for landscape genetic, biogeographic and species distribution model analyses. Methods in Ecology and Evolution, 5, 694–700. https://doi.org/10.1111/2041-210X.12200
Burgiel, S.W. y Muir, A.A. (2010). Invasive species, climate change and ecosystem-based adaptation: Addressing multiple drivers of global change. Global Invasive Species Programme (GISP). https://portals.iucn.org/library/node/9688
Carneiro, L., Miiler, N.O.R., Cuthbert, R.N. y Vitule, J.R.S. (2024). Biological invasions negatively impact global protected areas. Science of the Total Environment, 948, 174823. https://doi.org/10.1016/j.scitotenv.2024.174823
Carneiro, L., Miiler, N.O.R., Prestas, J.G., Vitule, J.R.S. y Cuthbert, R.N. (2025). Impacts and mechanisms of biological invasions in global protected areas. Biological Invasions, 27, 20. https://doi.org/10.1007/s10530-024-03498-w
Chinchio, E., Crotta, M., Romeo, C., Drewe, J.A., Guitian, J. y Ferrari, N. (2020). Invasive alien species and disease risk: An open challenge in public and animal health. PLoS Pathogens, 16(10), e1008922. https://doi.org/10.1371/journal.ppat.1008922
Cobos, M.E., Peterson, A.T., Barve, N. y Osorio-Olvera, L. (2019). kuenm: an R package for detailed development of ecological niche models using Maxent. Peer Journal, 7, e6281. https://doi.org/10.7717/peerj.6281.
Comité Asesor Nacional sobre Especies Invasoras. (2010). Estrategia Nacional sobre especies invasoras en México. Prevención, control y erradicación. CONABIO, CONANP y SEMARNAT. México. https://bioteca.biodiversidad.gob.mx/janium/Documentos/6643.pdf
Comisión Nacional de Áreas Protegidas [CONANP]. (2025). Áreas Naturales Protegidas. CONANP. México. https://www.gob.mx/conanp/documentos/areas-naturales-protegidas-278226
Comisión Nacional para el Conocimiento y Uso de la Biodiversidad [CONABIO]. (2016). Estrategia Nacional sobre Biodiversidad de México y Plan de acción 2016-2030. CONABIO.
Comisión Nacional para el Conocimiento y Uso de la Biodiversidad [CONABIO]. (2023). Información sobre Especies Invasoras en el Sistema Nacional de Información sobre Biodiversidad. CONABIO. https://www.biodiversidad.gob.mx/especies/Invasoras
D’Antonio, C., Levine, J. y Thomson, M.A. (2001). Ecosystem resistance to invasion and the role of propagule supply: a California perspective. Journal of Mediterranean Ecology, 2, 233-245. https://labs.eemb.ucsb.edu/dantonio/carla/CV_Publications/dantonio_levine_thomsen_2001.pdf
Dueñas, M.A., Hemming, D.J., Roberts, A. y Diaz-Soltero, H. (2021). The threat of invasive species to IUCN-listed critically endangered species: A systematic review. Global Ecology and Conservation, 26, e01476. https://doi.org/10.1016/j.gecco.2021.e01476
El-Barougy, R.F., Dakhil, M.A., Halmy, M.W., Gray, S.M., Abdelaal, M., Khedr, A-H. A. y Bersier, L-F. (2021). Invasion risk assessment using trait-environment and species distribution modelling techniques in an arid protected area: Towards conservation prioritization. Ecological Indicators, 129, 107951. https://doi.org/10.1016/j.ecolind.2021.107951
Elith, J.H., Graham, C.P.H., Anderson, R.P., Dudik, M., Ferrier, S., Guisan, A., Hijmans, R.S., Huettmann, F., Leathwick, J.R., Lehmann, A., Li, J., Lohmann, L.G., Loiselle, B.A., Manion, G., Moritz, C., Nakamura, M., Nakazawa, Y., Overton, J.M.M., Peterson, A.T., Phillips, S.J., …. y Zimmermann, N.E (2006). Novel methods improve prediction of species’ distributions from occurrence data. Ecography, 29, 129–151. https://doi.org/10.1111/j.2006.0906-7590.04596.x
Elith, J.H., Phillips, S.J., Hastie, T., Dudík, M., Chee, Y.E. y Yates, C.J. (2011). A statistical explanation of MaxEnt for ecologists. Diversity and Distributions, 17, 43–57. https://doi.org/10.1111/j.1472-4642.2010.00725.x
Environmental Systems Research Institute [ESRI]. (2014). ArcGIS for Desktop 10.2. https://www.esri.com.
Eyring, V., Bony, S., Meehl, G.A., Senior, C.A., Stevens, B., Stouffer, R.J. y Taylor, K.E. (2016).Overview of the Coupled Model Intercomparison Project Phase 6 (CMIP6) experimental design and organization Geoscientific Model Development, 9, 1937-1958. https://doi.org/10.5194/gmd-9-1937-2016
Fick, S.E. y Hijmans, R.J. (2017). WorldClim 2: new 1km spatial resolution climate surfaces for global land areas.International Journal of Climatology, 37(12), 4302-4315. https://doi.org/10.1002/joc.5086
Finch, D.M., Buttler, J.L., Runyon, J.B., Fettig, C.J., Kilkenny, F.F., Jose, S., Frankel, S.J., Cushman, S.A., Cobb, R.C. y Dukes, J.S. (2021). Effects of Climate Change on Invasive Species. En T.M. Poland, T. Patel-Weynand, D.M. Finch, C.F. Miniat, D.C. Hayes y V.M. Lopez (eds.), Invasive Species in Forests and Rangelands of the United States (pp. 57-83). Springer, Cham. https://doi.org/10.1007/978-3-030-45367-1_4
Foxcroft, L.C., Pyšek, P., Richardson, D.M., Genovesi, P. y MacFadyen, S. (2017). Plant invasion science in protected areas: progress and priorities. Biological Invasions, 19, 1353–1378. https://doi.org/10.1007/s10530-016-1367-z
Gallagher, R.V., Beaumont, L.J., Hughes, L. y Leishman, M.R. (2010). Evidence for climatic niche and biome shifts between native and novel ranges in plant species introduced to Australia. Journal of Ecology, 98, 790-799. https://doi.org/10.1111/j.1365-2745.2010.01677.x
Gallardo, B., Bacher, S., Barbosa, A.M., Gallien, L., González-Moreno, P., Martínez-Bolea, V., Sorte, C., Vimercati, G. y Vilà, M. (2024). Risks posed by invasive species to the provision of ecosystem services in Europe. Nature Communications, 15, 2631. https://doi.org/10.1038/s41467-024-46818-3
Gastelum-Mendoza, F.I., González-Saldívar, F.N., Lozano-Cavazos, E.A., Uvalle-Sauceda, J.I., Serna-Lagunes, R. y Cantú-Ayala, C.M. (2023). Hábitos forrajeros de Ammotragus lervia (Pallas, 1777) (Artiodactyla: Bovidae) en matorral desértico rosetófilo de Coahuila, México. Acta Zoológica Mexicana (nueva serie), 39, 1–17. https://doi.org/10.21829/azm.2023.3912581
Global Biodiversity Information Facility [GBIF.org] (8 de septiembre de 2023). Streptopelia decaocto in GBIF. Occurrence Download. https://www.gbif.org/occurrence/download/0009129-230828120925497
Global Biodiversity Information Facility [GBIF.org]. (4 de junio de 2024). Ammotragus lervia in GBIF (Global Biodiversity Information Facility) Occurrence Download. https://doi.org/10.15468/dl.6gdjpe
Global Biodiversity Information Facility [GBIF.org]. (4 de junio de 2024). Sus scrofa in GBIF (Global Biodiversity Information Facility) Occurrence Download. https://doi.org/10.15468/dl.wh4tts
Guisan, A. y Thuiller, W. (2005). Predicting species distribution: offering more than simple habitat models. Ecology Letters, 8, 993–1009. https://doi.org/10.1111/j.1461-0248.2005.00792.x
Gutiérrez-Zapata, S., Santoro, S., Gegundez-Arías, M.E., Selva, N. y Calzada, J. (2024). Dog invasions in protected areas: a case study using camera, trapping, citizen science and artificial intelligence. Global Ecology and Conservation, 54, e03109. https://doi.org/10.1016/j.gecco.2024.e03109
Habibullah, M. S., Din, B. H., Tan, S. H. y Zahid, H. (2022). Impact of climate change on biodiversity loss: global evidence. Environmental Science and Pollution Research, 29(1), 1073-1086. https://doi.org/10.1007/s11356-021-15702-8
Hanley, N. y Roberts, M. (2019). The economic benefits of invasive species management. People and Nature, 1, 124-137. https://doi.org/10.1002/pan3.31
Hijmans, R.J. (2021). Geographic data analysis and modeling. R package raster version 3.4-10. https://cran.r-project.org/package=raster
Instituto Nacional de Estadística y Geografía [INEGI]. (2022). Atlas territorial de México. INEGI. https://www.inegi.org.mx/app/biblioteca/ficha.html?upc=889463906223
Intergovernmental Panel on Climate Change [IPCC]. (2021). Summary for Policymakers. En V. Masson-Delmotte, P. Zhai, A. Pirani, A., S.L. Connors, S.L., et al. (coords.), Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change (pp. 3–32), IPCC (Intergovernmental Panel on Climate Change). Cambridge University Press.
Kapitza, K., Zimmermann, H., Martin-López, B. y von Wehrden, H. (2019). Research on the social perception of invasive species: a systematic literature review. NeoBiota, 43, 47-68. https://doi.org/10.3897/neobiota.43.31619
Kariyawasam, C.S., Kumar, L. y Ratnayake, S.S. (2020). Potential risks of plant invasions in protected areas of Sri Lanka under climate change with special reference to threatened vertebrates. Climate, 8(4), 51. https://doi.org/10.3390/cli8040051
Kearing, M. y Porter, W. (2009). Mechanistic niche modelling: combining physiological and spatial data to predict species’ ranges. Ecology Letters, 12, 334-350. https://doi.org/10.1111/j.1461-0248.2008.01277.x
Kettenring, K.M. y Adams, C.R. (2011). Lessons learned from invasive plant control experiments: a systematic review and meta-analysis. Journal of Applied Ecology, 48, 970–979. https://doi.org/10.1111/j.1365-2664.2011.01979.x
Koenig, W.D. (2020). What are the competitive effects of invasive species? Forty years of the Eurasian collared-dove in North America. Biological Invasions, 22, 3645–3652. https://doi.org/10.1007/s10530-020-02350-1
Liu, C., White, M. y Newell, G. (2013). Selecting thresholds for the prediction of species occurrence with presence-only data. Journal of Biogeography, 40, 778-789. https://doi.org/10.1111/jbi.12058
Luna, I., Morrone, J.J. y Espinosa, D. (2004). Biodiversidad de la Sierra Madre Oriental. Facultad de Ciencias, Universidad Nacional Autónoma de México.
Ludwick, T.J., Fedynich, A.M. y Fitzsimmons, O.N. (2023). Breeding ecology of a columbid community occurring in south Texas with focus on Eurasian collared-doves (Streptopelia decaocto). The Southwestern Naturalist, 67(1), 1-9. https://doi.org/10.1894/0038-4909-67.1.1
McDonough, M.T., Ditchkoff, S.S., Smith, M.D. y Vercauteren, K.C. (2022). A review of the impacts of invasive wild pigs on native vertebrates. Mammalian Biology, 102, 279–290. http://doi.org/10.1007/s42991-022-00234-6
Melillo, J.M., Lu, X., Kicklighter, D.W., Reilly, J.M., Cai, Y. y Sokolov, A.P. (2016). Protected areas’ role in climate-change mitigation. Ambio, 45, 133–145. https://doi.org/10.1007/s13280-015-0693-1
Merow, C., Smith, M.J., Edwards Jr., T.C., Thomas, C., Guisan, A., McMahon, S.M., Normand, S., Thuiller, W., Wüest, R.O., Zimmermann, N.E. y Elith, J. (2014). What do we gain from simplicity versus complexity in species distribution models? Ecography, 37, 1267–1281. https://doi.org/١٠.١١١١/ecog.٠٠٨٤٥
Naciones Unidas. (2023). Informe de los Objetivos de Desarrollo Sostenible. Naciones Unidas. https://www.un.org/sustainabledevelopment/es/climate-change-2/
Naimi, B. (2015). usdm: Uncertainty analysis for species distribution models. R Package v. 1. https://cran.r-project.org/web/packages/usdm/
Naimi, B. y Araújo, M.B. (2016). sdm: A reproducible and extensible R platform for species distribution modelling. Ecography, 39, 368–375. https://doi.org/10.1111/ecog.01881
Orozco, L., López-Pérez, A. M., Zarza, H., Suzán, G. y List, R. (2022). Dog demography and husbandry practices facilitate dog-wildlife conflict in a suburban-forest interface. Urban Ecosystems, 25(6), 1725-1734. https://doi.org/10.1007/s11252-022-01251-6
Packer, J.G., Meyerson, L.A., Richardson, D.M., … y Pyšek, P. (2017). Global networks for invasion science: benefits, challenges and guidelines. Biological Invasions, 19(4), 1081–1096. https://doi.org/10.1007/s10530-016-1302-3.
Pepin, K.M., Davis, A.J., Beasley, J., Boughton, R., Campbell, T., Cooper, S.M., Gaston, W., Hartley, S., Kilgo, J.C., Wisely, S.M., Wyckoff, C. y VerCauteren, K.C. (2016). Contact heterogeneities in feral swine: Implications for disease management and future research. Ecosphere, 7, 1–11. https://doi.org/10.1002/ecs2.1230
Peterson, A.T., Papes, M. y Soberón, J. (2008). Rethinking receiver operating characteristic analysis applications in ecological niche modeling. Ecological Modelling, 213, 63–72. https://doi.org/10.1016/j.ecolmodel.2007.11.008
Petitpierre, B., Kueffer, C., Broennimann, O, Randin, C., Daehler, C. y Guisan, A. (2012). Climatic niche shifts are rare among terrestrial plant invaders. Science, 335, 1344-1348. https://doi.org/10.1126/science.1215933
Phillips, S.J., Anderson, R.P. y Schapire, R.E. (2006). Maximum entropy modeling of species geographic distributions. Ecological Modelling, 190, 231-259. https://doi.org/10.1016/j.ecolmodel.2005.03.026
Phillips, S.J., Anderson, R.P., Dudík, M., Schapire, R.E. y Blair, M.E. (2017). Opening the black box: An open-source release of Maxent. Ecography, 40, 887–893. https://doi.org/10.1111/ecog.03049
Pirani, A., Fuglestvedt, J.S., Byers, E., O’neill, B., Riahi, K., Lee, J.-Y., Marotzke, J., Rose, S.K., Schaeffer, R. y Tebaldi, C. (2024). Scenarios in IPCC assessments: Lessons from AR6 and opportunities for AR7. npj Climate Action, 3, 1. https://doi.org/10.1038/s44168-023-00082-1
Poling, T.D. y Hayslette, S.D. (2006). Dietary overlap and foraging competition between mourning doves and Eurasian collared-doves. Journal of Wildlife Management, 70(4), 998-1004. https://doi.org/10.2193/0022-541X(2006)70[998:DOAFCB]2.0.CO;2
Pulido-Chadid, K., Virtanen, E. y Geldmann, J. (2023). How effective are protected areas for reducing threats to biodiversity? A systematic review protocol. Environmental Evidence, 12,18. https://doi.org/10.1186/s13750-023-00311-4
R Core Team. (2021). R: a language and environment for statistical computing. R Foundation for Statistical Computing. https://www.R-project.org/
Ramírez-Albores, J.E. y Badano, E. (2021). Alien species as counterpart of a megadiverse country as Mexico. Management of Biological Invasions, 12, 828-845. https://doi.org/10.3391/mbi.2021.12.4.04
Ramírez-Albores, J.E., Sánchez-González, L.A., Prieto-Torres, D.A. y Navarro-Sigüenza, A.G. (2024). Where are going now? The current and future distributions of the Monk parakeet (Myiopsitta monachus) and Eurasian collared dove (Streptopelia decaocto) in a megalopolis. Sustainability, 16, 7071. https://doi.org/10.3390/su16167071
Rekiel, A., Więcek, J. y Sońta, M. (2024). Wild boar (Sus scrofa L. 1758), a problematic but also a useful species—A review. Journal of Elementology, 29(3), 573-590. https://doi.org/10.5601/jelem.2023.28.4.3248
Risch, D.R., Ringma, J. y Price, M.R. (2021). The global impact of wild pigs (Sus scrofa) on terrestrial biodiversity. Scientific Reports, 11(1), 13256. https://doi.org/10.1038/s41598-021-92691-1
Rodríguez-García, A., González-Saldívar, F.N., Cantú-Ayala, C.M. y Uvalle-Sauceda, J.I. (2023). Food competition between Barbary sheep (Ammotragus lervia Pallas, 1777) and Bighorn sheep (Ovis canadensis Shaw, 1804) in Coahuila State. Revista Mexicana de Ciencias Forestales, 14, 294-316. https://doi.org/10.29298/rmcf.v14i79.1358
Roy, H.E., Hesketh, H., Purse, B.V., Eilenberg, J., Santini, A., Scalera, R., Stentiford, G.D., Adriaens, T., Bacela-Spychelska, K., Bass, D., Beckmann, K.M., Bessell, P., Bojko, J., Booy, O., Cardoso, A.C., Essl, F., Groom, Q., Harrower, C., Kleespies, R., … y Dunn, A.M. (2017). Alien pathogens on the horizon: opportunities for predicting their threat to wildlife. Conservation Letters, 10, 477-484. https://doi.org/10.1111/conI.12297
Sax, D.F., Stachowicz, J.J., Brown, J.H., Bruno, J.F., Dawson, M.N., Gaines, S.D., Grosberg, R.K., Hastings, A. y Holt, R.D. (٢٠٠٧). Ecological and evolutionary insights from species invasions. Trends in Ecology and Evolution, 22(9), ٤٦٥–٤٧١. https://doi.org/10.1016/j.tree.2007.06.009
Selwood, K.E. y Zimmer, H.C. (2020). Refuges for biodiversity conservation: a review of the evidence. Biological Conservation, 245,108502. https://doi.org/10.1016/j.biocon.2020.108502
Sexton, J.P., McIntyre, P.J., Angert, A.L. y Rice, K.J. (2009). Evolution and ecology of species range limits. Annual Review of Ecology, Evolution, and Systematics, 40, 415–436. https://doi.org/10.1146/annurev.ecolsys.110308.120317
Shackleton, R.T., Biggs, R., Richardson, D.M. y Larson, B.M.H. (2018). Social-ecological drivers and impacts of invasion-related regime shifts: consequences for ecosystem services and human wellbeing. Environmental Science and Policy, 89, 300-314. https://doi.org/10.1016/j.envsci.2018.08.005
Shao, Y., Ethier, D.M. y Bonner, S.J. (2024). Invasion dynamics of the European Collared-dove in North America are explained by combined effects of habitat and climate. Ornithological Applications, 126(1), duad052. https://doi.org/10.1093/ornithapp/duad052
Shea, K. y Chesson, P. (2002). Community ecology theory as a framework for biological invasions. Trends in Ecology and Evolution, 17(4), 170-176. https://doi.org/10.1016/S0169-5347(02)02495-3.
Shivanna, K.R. (2022). Climate change and its impact on biodiversity and human welfare. Proceedings of the Indian National Science Academy, 88, 160–171. https://doi.org/10.1007/s43538-022-00073-6
Schwoerer, T., Schmidt, J.I., Davis, T.J. y Martin, A.E. (2024). Human-connected wild lands: How network analysis can inform invasive species management. Biological Conservation, 299, 110797. https://doi.org/10.1016/j.biocon.2024.110797
Soberón, J. y Peterson, A.T. (2005). Interpretation of models of fundamental ecological niches and species’ distributional areas. Biodiversity Informatics, 2, 1-10. https://doi.org/10.17161/bi.v2i0.4
Sutton, G.F. y Martin, G.D. (2022). Testing MaxEnt model performance in a novel geographic region using an intentionally introduced insect. Ecological Modelling, 473, 110139. https://doi.org/10.1016/j.ecolmodel.2022.110139
Taylor, M. y Figgis P. (2007). Protected Areas: Buffering nature against climate change. En Proceedings of a WWF and IUCN World Commission on Protected Areas Symposium, 18-19 de junio de 2007. WWF.
Tebaldi, C., Debeire, K., Eyring, V., Fischer, E., Fyfe, J., Friedlingstein, P., Knutti, R., Lowe, J., O´Neill, B., Sanderson, B., van Vuuren, D., Riahi, K., Meinshausen, M., Nicholls, Z., Tokarska, K.B., Hurtt., G., Kriegler, E., Lamarque, J.-F., Meehl, G., … Ziehn, T. (2021). Climate model projections from the scenario model intercomparison project (scenario MIP) of CMIP6. Earth System Dynamics, 12, 253–293. https://doi.org/10.5194/esd-12-253-2021
Thomas, C.D. y Gillingham, P.K. (2015). The performance of protected areas for biodiversity under climate change. Biological Journal of the Linnean Society, 115, 718–730. https://doi.org/10.1111/bij.12510
Venette, R.C., Gordon, D.R., Juzwik, J., Koch, F.H., Liebhold, A.M., Peterson, R.K.D., Sing, S.E. y Yemshanov, D. (2021). Early Intervention Strategies for Invasive Species Management: Connections Between Risk Assessment, Prevention Efforts, Eradication, and Other Rapid Responses. En T.M. Poland, T. Patel-Weynand, D.M. Finch, C.F. Miniat, D.C. Hayes y V.M. Lopez (eds.), Invasive Species in Forests and Rangelands of the United States. Springer, Cham. https://doi.org/10.1007/978-3-030-45367-1_6
Vicente, J.R., Fernandes, R.F., Randin, C.F., Juzwik, J., Koch, F.H., Liebhold, A.M., Peterson, R.K.D., Sing, S.E. y Yemshanov, D. (2013). Will climate change drive alien invasive plants into areas of high protection value? An improved model-based regional assessment to prioritise the management of invasions. Journal of Environmental Management, 131, 185–195. https://doi.org/10.1016/j.jenvman.2013.09.032
Villaseñor, J.L., Encina-Domínguez, J.A., Estrada-Castillón, E., Hinton, G.S., Mora-Olivo, A., Ortiz, E. y Villarreal-Quintanilla, J.A. (2023). Diversidad florística de la región noreste de México, estados de Coahuila, Nuevo León y Tamaulipas. Botanical Sciences, 101, 1301-1319. https://doi.org/10.17129/botsci.3328
Warren, D.L. y Seifert, S.N. (2011). Ecological niche modeling in Maxent: The importance of model complexity and the performance of model selection criteria. Ecological Applications, 21, 335–342. https://doi.org/10.1890/10-1171.1
Wenger, S.J. y Olden, J.D. (2012). Assessing transferability of ecological models: An underappreciated aspect of statistical validation. Methods Ecology and Evolution, 3, 260–267. https://doi.org/10.1111/j.2041-210X.2011.00170.x
Wiens, J.J., Ackerly, D.D., Allen, A.P., Anacker, B.L., Buckley, L.B., Cornell, H.V., Damschen, E.I., Davies, T.J., Grytnes, J.-A., Harrison, S.P., Hawkins, B.A., Holt, R.D., McCain, C.M. y Stephens, P.R. (2010). Niche conservatism as an emerging principle in ecology and conservation biology. Ecology Letters, 13(10), 1310–01324. https://doi.org/10.1111/j.1461-0248.2010.01515.x
Yates, K.L., Bouchet, P.J., Caley, M.J., Mengersen, K., Randin, C.F., Parnell, S., Fielding, A.H., Bamford, A.J., Ban, S., Barbosa, A.M., Dormann, C.F., Elith, J., Embling, C.B., Ervin, G.N., Fisher, R., Gould, S., Graf, R.F., Gregr, E.J., Halpin, P.N., Heikkinen, R.K. y Sequeira, A.M.M. (2018). Outstanding challenges in the transferability of ecological models. Trends in Ecology and Evolution, 33, 790–802. https://doi.org/10.1016/j.tree.2018.08.001
Yiwen, Z., Wei, L-B. y Yeo, D.C.J. (2016). Novel method to select environmental variables in MaxEnt: a case study using invasive crayfish. Ecological Modelling, 341, 5-13. https://doi.org/10.1016/j.ecolmodel.2016.09.019
Zanón-Martínez, J. I., Santillán, M.A., Sarasola, J.H. y Travaini, A. (2016). A native top predator relies on exotic prey inside a protected area: The puma and the introduced ungulates in Central Argentina. Journal of Arid Environments, 1341, 17– 20. https://doi.org/10.1016/j.jaridenv.2016.06.015
-------------------------------------------------------------------------------------------
* La Universidad Autónoma Agraria Antonio Narro (UAAAN) promueve, a través de sus diferentes programas docentes, la formación de profesionales con sentido de servicio a la comunidad al entender los problemas ambientales, y así proponer soluciones innovadoras y amigables para un desarrollo agrícola más equilibrado con el ambiente. Un ejemplo de esto es el desarrollo del proyecto “Plagas e invasiones biológicas en áreas naturales del noreste de México: modelos predictivos en escenarios de cambio climático (38111-425104001-2389)”, con el apoyo de los Fondos Institucionales de Investigación de la UAAAN, del Área de Protección de Flora y Fauna Maderas del Carmen (APFF Maderas del Carmen), y del Área de Protección de Flora y Fauna Ocampo (APFF Ocampo), a través de la Comisión Nacional de Áreas Naturales Protegidas (CONANP), y de la Reserva Estatal Sierra de Zapalinamé a través de PROFAUNA. Este artículo se enfoca en analizar e identificar el grado de cambio en espacios adecuados por la presencia de especies invasoras ante escenarios de cambio climático en función de sus requerimientos ambientales y distribución geográfica, y aplicar dichos conocimientos a la planificación sistemática de la conservación en áreas naturales protegidas, así como de sus servicios ecosistémicos que estas proveen.
**Jorge E. Ramírez-Albores. Profesor-investigador del Departamento de Botánica, Universidad Autónoma Agraria Antonio Narro (UAAAN). Contribución: compilación de la información, conceptualización, análisis formal, curación de datos, revisión, visualización, metodología, investigación, redacción y edición. Últimas publicaciones: Ramírez-Albores, J.E. (2025). Avian community structure and spatial distribution in anthropogenic landscapes in central Mexico. Birds, 6, 18. Ramírez-Albores, J.E., Sánchez-González, L.A., Prieto-Torres, D.A. y Navarro-Sigüenza, A.G. (2024). Where are going now? The current and future distributions of the Monk parakeet (Myiopsitta monachus) and Eurasian collared dove (Streptopelia decaocto) in a megalopolis. Sustainability, 16 (16), 7071. jorgeramirez22@hotmail.com. ORCID: https://orcid.org/0000-0001-5295-3717
***Heliot Zarza. Profesor-investigador del Departamento de Ciencias Ambientales, Universidad Autónoma Metropolitana Unidad Lerma (UAM Lerma). Contribución específica del artículo: análisis formal, revisión, visualización, investigación y redacción. h.zarza@correo.ler.uam.mx. ORCID: https://orcid.org/0000-0003-2127-0811
****Marlín Pérez-Suárez. Profesor-investigador del Instituto de Ciencias Agropecuarias y Rurales (ICAR), Universidad Autónoma del Estado de México (UAEMex). Contribución específica del artículo: análisis formal, revisión, visualización, investigación y redacción. marpersua@gmail.com. ORCID: https://orcid.org/0000-0001-9996-4771
*****José F. González-Maya. Profesor-investigador del Departamento de Ciencias Ambientales, Universidad Autónoma Metropolitana Unidad Lerma (UAM Lerma). Contribución específica del artículo: análisis formal, revisión, visualización, investigación y redacción. jf.gonzalez@correo.ler.uam.mx https://orcid.org/0000-0002-8942-5157
******J. Javier Ochoa-Espinoza. Profesor-investigador del Departamento de Recursos Naturales Renovables, Universidad Autónoma Agraria Antonio Narro (UAAAN). Contribución específica del artículo: análisis formal, revisión, visualización, investigación y redacción. jjochoae@gmail.com. ORCID: https://orcid.org/0000-0002-2140-8676