Estrategias de formulación de inoculantes microbianos como complemento para una agricultura más sostenible en el tiempo
Wilson Gabriel Rodríguez Escucha*
Universidad INNCA de Colombia y Universidad de los Andes (Colombia)
Claudia Paola Manquillo Hoyos**
Universidad INNCA de Colombia (Colombia)
Lizeth Adriana Ballesteros Galindo***
Universidad INNCA de Colombia (Colombia)
Naturaleza y Sociedad. Desafíos Medioambientales • número 14 • enero-abril, 2026 • pp. 1-32
https://doi.org/10.53010/nys14.05
Recibido: 21 de julio de 2025 | Aceptado: 21 de octubre de 2025
Resumen. Los inoculantes microbianos constituyen alternativas sostenibles a los fertilizantes y pesticidas sintéticos, para disminuir la degradación de los suelos y fortalecer la productividad agrícola. El objetivo de esta revisión consistió en analizar las estrategias de formulación que permitan mantener la viabilidad y eficacia de microorganismos benéficos como bacterias promotoras del crecimiento vegetal (PGPR) y hongos, frente a condiciones ambientales adversas y en el marco de prácticas agrícolas sostenibles. La metodología consistió en un análisis sistemático de literatura científica publicada entre 1992 y 2025 a través del método PRISMA, y búsquedas en bases de datos especializadas (Web of Science, PubMed, NCBI y Google Scholar). Se seleccionaron artículos originales, revisiones científicas y documentos regulatorios, y se priorizaron estudios sobre formulación de inoculantes, carriers de estabilidad microbiana y regulación de bioinsumos agrícolas, categorizados por temáticas relacionadas. Entre los hallazgos más relevantes se destacan las técnicas de encapsulación y coencapsulación con metabolitos protectores, el empleo de carriers sólidos, líquidos y biopolímeros, y el desarrollo de consorcios microbianos que aumentan la estabilidad y funcionalidad de los bioinoculantes. Asimismo, se identificaron desafíos asociados a la interacción de los inoculantes con la microbiota nativa del suelo, las condiciones edafoclimáticas y la compatibilidad con insumos y prácticas agronómicas convencionales. En conclusión, este análisis permitió establecer que la eficacia de los inoculantes microbianos depende tanto de la selección de cepas eficientes, como de su adecuada formulación y aplicación en campo, factores determinantes para garantizar su estabilidad y desempeño. El artículo aporta una visión actualizada sobre las tendencias y desafíos en la formulación de inoculantes microbianos, al destacar su papel en la transición hacia una agricultura sostenible y resiliente en el tiempo.
Palabras clave: agricultura, degradación de suelos, formulación, inoculantes biológicos, método PRISMA, microorganismos.
Strategies for formulating microbial inoculants as a complement for more sustainable agriculture over time
Abstract. Microbial inoculants provide sustainable alternatives to synthetic fertilizers and pesticides, helping to reduce soil degradation and increase agricultural productivity. This review aimed to analyze formulation strategies that maintain the viability and effectiveness of beneficial microorganisms, such as plant growth-promoting rhizobacteria (PGPR) and fungi, under challenging environmental conditions and within the context of sustainable agricultural practices. The methodology involved a systematic review of scientific literature published from 1992 to 2025, using the PRISMA method, and searches of specialized databases (Web of Science, PubMed, NCBI, and Google Scholar). Original articles, scientific reviews, and regulatory documents were selected, focusing on studies related to inoculant formulation, microbial stability carriers, and the regulation of agricultural bio-inputs, categorized by relevant themes. Key findings include encapsulation and co-encapsulation techniques with protective metabolites, use of solid, liquid, and biopolymer carriers, and the development of microbial consortia that enhance the stability and functionality of bioinoculants. Challenges were identified concerning the interaction of inoculants with native soil microbiota, edaphoclimatic conditions, and compatibility with inputs and conventional agronomic practices. In conclusion, this analysis demonstrated that the effectiveness of microbial inoculants depends on selecting efficient strains and ensuring proper formulation and application in the field—crucial factors for maintaining their stability and performance. This article provides an updated perspective on current trends and challenges in formulating microbial inoculants, highlighting their role in advancing toward sustainable and resilient agriculture.
Keywords: agriculture, soil degradation, formulation, biological inoculants, PRISMA method, microorganisms.
Estratégias de formulação de inoculantes microbianos como complemento a uma agricultura mais sustentável ao longo do tempo
Resumo. Os inoculantes microbianos são alternativas sustentáveis aos fertilizantes sintéticos e pesticidas para reduzir a degradação do solo e fortalecer a produtividade agrícola. O objetivo desta revisão é analisar as estratégias de formulação que permitam manter a viabilidade e a eficácia de microrganismos benéficos, como bactérias promotoras do crescimento das plantas (PGPR, em inglês) e fungos, diante de condições ambientais adversas e dentro do quadro de práticas agrícolas sustentáveis. A metodologia consistiu em uma análise sistemática da literatura científica publicada entre 1992 e 2025 pelo método PRISMA, e buscas em bases de dados especializadas (Web of Science, PubMed, NCBI e Google Scholar). Artigos originais, revisões científicas e documentos regulatórios foram selecionados, e estudos sobre formulação de inoculantes, portadores de estabilidade microbiana e regulação de bioinsumos agrícolas foram priorizados e categorizados por tópicos relacionados. Entre os achados mais relevantes estão as técnicas de encapsulamento e coencapsulamento com metabólitos protetores, o uso de portadores sólidos, líquidos e biopolímeros, e o desenvolvimento de consórcios microbianos que aumentam a estabilidade e a funcionalidade dos bioinoculantes. Da mesma forma, foram identificados desafios associados à interação dos inoculantes com a microbiota nativa do solo, condições edafoclimáticas, além da compatibilidade com insumos convencionais e práticas agronômicas. Em conclusão, essa análise permitiu estabelecer que a eficácia dos inoculantes microbianos depende tanto da seleção de cepas eficientes quanto de sua formulação adequada e aplicação em campo, determinando fatores que garantam sua estabilidade e desempenho. Este artigo oferece uma visão atualizada sobre tendências e desafios na formulação de inoculantes microbianos, destacando seu papel na transição para uma agricultura sustentável e resiliente.
Palavras-chave: agricultura, degradação do solo, formulação, inoculantes microbianos, método PRISMA, microrganismos.
Introducción
La degradación del suelo representa una amenaza para la sostenibilidad agrícola, lo que afecta la productividad, la estabilidad de los ecosistemas y la seguridad alimentaria global (FAO et al., 2015; Montgomery et al., 2007). Factores como la erosión, la salinización, el agotamiento de la materia orgánica y la contaminación por agroquímicos han alterado profundamente la estructura físico-química y biológica de los suelos agrícolas (Ideam et al., 2017; Panagos et al., 2014).
Estas problemáticas limitan el rendimiento de los cultivos, intensifican fenómenos globales como el cambio climático y la pérdida de biodiversidad —lo que limita el flujo de materia en los suelos— y de funcionalidad de los microbiomas (Wei et al., 2024; Ni et al., 2025). Según Panagos et al. (2014), aproximadamente el 25 % de los territorios de la Unión Europea presentan una tasa de erosión por encima del umbral sostenible de 2 t/ha·año, y más del 6 % de las tierras agrícolas sufren erosión severa (≥ 11 t/ha·año). De igual manera, este fenómeno en los terrenos agrícolas de Estados Unidos puede alcanzar en promedio ~0,5 mm/año, unas 5 veces más que las tasas naturales, equivalentes a aproximadamente 5 t/ha·año (Montgomery et al., 2007; Panagos et al., 2014).
A nivel local, Colombia no es la excepción, pues para el año 2016 se reportó que el 40 % de su territorio continental e insular —equivalente a 45 479 058 hectáreas— presentan algún grado de erosión. Por ejemplo, departamentos como Cundinamarca y Boyacá tienen entre un 70 y 80 % de su territorio con algún grado de erosión, lo que ha causado la pérdida de la capacidad productiva de regiones que históricamente han sido de importancia agrícola en cultivos como papa, tomate, lechuga y otros vegetales (Ideam et al., 2017). Debido a ello, se requieren esfuerzos que integren avances técnicos y científicos para fomentar una transición que busque la implementación de nuevas alternativas para reducir las concentraciones de fertilizantes que contribuyen al desgaste de los suelos (Mosier et al., 2021). Una las estrategias más prometedoras es el desarrollo de bioinsumos a base de rizobacterias promotoras del crecimiento vegetal (Plant Growth Promoting Rhizobacteria, o PGPR), hongos, algas y otros seres vivos con la capacidad de estimular y optimizar mecanismos como la defensa de las plantas, la absorción de nutrientes, la resistencia a salinidad, la sequía, el crecimiento y las interacciones de cooperación entre ellas (Compant et al., 2019). Un ejemplo de ello es Rhizobiol, inoculante líquido elaborado con base en una mezcla de bacterias simbióticas fijadoras de nitrógeno, desarrollado por la empresa colombiana Agrosavia, cuyo ingrediente activo es Bradyrhizobium japonicum, y su función es mejorar la absorción de nitrógeno en los cultivos. Otra rama de productos es Actybac, que actúa regulando agentes fitopatógenos como Burkholderia glumae, Pseudomonas fuscovaginae o Fusarium oxysporum (Basu et al., 2021; Bini et al., 2024; Greffe y Michiels, 2020, Riaz et al., 2021).
En este contexto, la aplicación de inóculos biológicos representa una vía prometedora para la protección de los suelos y los cultivos como maíz (Zea mays) y soya (Glycine max), entre otros, al incrementar su rendimiento hasta en un 30 % en comparación con métodos tradicionales (Malusá et al., 2016). A pesar de que la implementación de bioinsumos para el manejo de cultivos es prometedor, aún tiene limitaciones como la variabilidad de su eficacia debido a condiciones ambientales como pH, humedad, temperatura o interacciones con la microbiota nativa (Malusá et al., 2012; Stephens et al., 2000). Con el fin de solucionar este problema, se han estudiado materiales que transporten y protejan a los principios activos como polímeros de alginato, suspensiones en biochar, carbón vegetal, turba y compost (dos Reis et al., 2024; Hungria et al., 2005; O’Callaghan et al., 2022; Saberi-Riseh et al., 2021), ya que contienen la carga biológica, prolongan la vida útil, facilitan el transporte y mantienen su función durante el almacenamiento y la aplicación.
Así, resulta fundamental analizar información que permita identificar estrategias para comprender los fundamentos de la formulación de inoculantes microbianos y los mecanismos que determinan su desempeño en campo. Con este propósito, el presente trabajo aborda, en primer lugar, el contexto actual de degradación del suelo y los desafíos que enfrenta la agricultura frente al uso intensivo de insumos químicos. En segundo lugar, se profundiza en los componentes de las formulaciones, explicando los tipos de carriers, coadyuvantes y los factores ambientales que pueden afectar su funcionamiento. Finalmente, se exploran los retos prácticos que limitan la adopción de estas tecnologías por parte de los productores, destacando la necesidad de avanzar hacia una transición gradual y efectiva hacia sistemas agroecológicos sostenibles.
Metodología
Este artículo recopila y analiza literatura científica relacionada con la formulación de inoculantes biológicos referente a estudios previos sobre bioinoculantes y formulaciones microbianas aplicadas en la agricultura, al integrar teorías de biotecnología agrícola, microbiología de suelos y agricultura sostenible. Las etapas que componen el proceso de revisión documental fueron: búsqueda en base de datos académicas, filtración de términos clave, operadores booleanos, criterios de inclusión y exclusión, categorización de información por temáticas, construcción de una matriz que sistematiza la información y su análisis posterior.
Estrategia de búsqueda e identificación de estudios
La búsqueda sistemática de información se realizó mediante las directrices del modelo PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) (Moher et al., 2009). Se consultaron bases de datos científicas reconocidas —Scopus, ScienceDirect, SpringerLink, Web of Science y Google Scholar— entre los años 1992 y 2025, y se priorizaron artículos revisados por pares relacionados con el uso de bioinoculantes y microorganismos promotores del crecimiento vegetal (PGPR) en agricultura sostenible.
Para asegurar una cobertura amplia, se emplearon palabras clave tanto en inglés como en español, combinadas mediante operadores booleanos (AND, OR, NOT). Por ejemplo:
“formulation AND microbial inoculants AND agriculture, biofertilizers AND soil health AND microbial formulations, encapsulation AND bioinoculants NOT chemical fertilizers”.
Entre los principales términos utilizados se incluyeron palabras como: “bioinoculante”, (bioinoculant), “inoculante microbiano” (microbial inoculant), “rizobacterias promotoras del crecimiento vegetal” (plant growth-promoting rhizobacteria), “estrategias de formulación”, (formulation strategies), “encapsulación con biopolímeros” (biopolymer encapsulation), “agricultura sostenible” (sustainable agriculture), “eficiencia en campo” (field efficiency).
Adicionalmente, se realizaron búsquedas cruzadas en los listados de referencias de los artículos seleccionados, con el fin de identificar literatura complementaria relevante. Toda la información obtenida se organizó en una base de datos construida en Microsoft Excel para sintetizar la información, que incluía: referencia bibliográfica, tipo de inoculante formulado (bacteria, hongo u otro), tipo de carrier y/o coadyuvante utilizado, método de formulación (encapsulación, coencapsulación, etc.), resultados y niveles de eficacia (en campo, laboratorio o invernadero), factores limitantes (condiciones edafoclimáticas e interacción con microbiota, entre otros), retos y perspectivas futuras.
Criterios de inclusión y exclusión
Los artículos recuperados fueron filtrados mediante la lectura de título, resumen y palabras clave, y se eliminaron duplicados y documentos no relacionados con la temática central. Se incluyeron estudios que fueran publicaciones científicas entre 1992 hasta 2025, artículos en inglés o español con enfoque en bioinoculantes PGPR o formulaciones microbianas aplicadas a cultivos agrícolas, estudios que reportaran datos experimentales o revisiones con evidencia sobre formulación, mecanismos fisiológicos o aplicación en campo. Además, se incluyeron publicaciones revisadas por pares para garantizar la calidad y validez de la información.
No se incluyeron documentos como tesis, reportes técnicos o resúmenes de congresos, artículos con restricciones al texto completo o sin información verificable sobre la metodología aplicada. Tampoco publicaciones acerca de bioinoculantes con objetivos diferentes a soluciones agrícolas como biorremediación o diferentes usos industriales.
Proceso de revisión y extracción de datos
Inicialmente se identificaron 243 registros1. Tras la eliminación de duplicados, se conservaron 186 documentos. De estos, 150 fueron evaluados en texto completo y finalmente 82 artículos cumplieron con los criterios de inclusión y se consideraron para el análisis cualitativo de la revisión. El proceso completo de búsqueda, selección y cribado se presenta en el diagrama de flujo PRISMA adaptado (Figura 1).
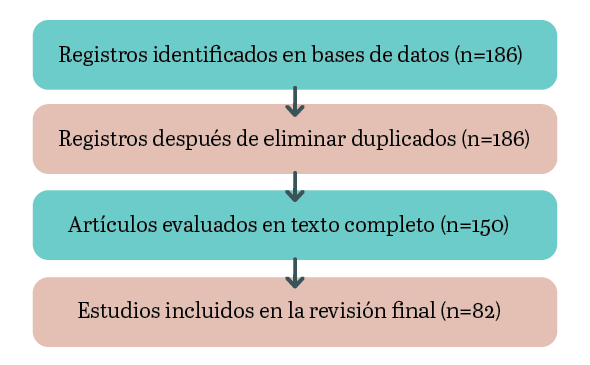
Figura 1. Diagrama de flujo PRISMA, adaptado para revisión de bioinoculantes. Fuente: elaboración propia, adaptado de Moher et al. (2009).
Síntesis y análisis de la información
La información fue organizada en categorías temáticas conforme a la relevancia de los hallazgos reportados, como el papel de los microorganismos como bioinoculantes en agricultura, estrategias de formulación y tipos de carriers, así como factores que afectan la eficiencia de los inoculantes en campo. Cada grupo fue analizado de manera descriptiva, al examinar las tendencias, avances tecnológicos y vacíos de investigación actuales.
Resultados
Se reportaron artículos que mencionan microorganismos con aplicaciones en agricultura, como los de los géneros Azospirillum, Bacillus y Pseudomonas, entre otros; así como los efectos observados en el crecimiento vegetal y tolerancia a diferentes tipos de estrés en cultivos bajo la implementación de inoculantes biológicos. También se discuten las principales estrategias de formulación y el uso de carriers destinados al transporte y liberación eficiente de los principios activos, sus ventajas y limitaciones. Por último, se aborda la aplicación de esta tecnología en condiciones de campo, al analizar los factores que determinan su eficiencia, como las condiciones edafoclimáticas. Se destaca, además, el papel de los bioinoculantes en la reducción del uso de agroquímicos y en la promoción de una agricultura más sostenible.
Papel de los microorganismos como bioinoculantes en agricultura
La aplicación de inóculos a base de microorganismos puede contribuir a resolver necesidades en la agricultura como la nutrición de los cultivos, la promoción de defensas contra patógenos, el estrés abiótico, el crecimiento y la resistencia contra plagas, entre otros aspectos (Bashan et al., 2014; Lugtenberg y Kamilova, 2009; Vessey, 2003). Bacterias como Azospirillum y Pseudomonas se encontraron en diversos estudios que describen sus aplicaciones, como la síntesis de ácido indolacético (AIA), una hormona clave para el desarrollo radicular, lo que aumenta la eficiencia de absorción del agua y nutrientes en las plantas (García et al., 2017; Vemmer y Patel, 2013; Zuffo et al., 2015). Asimismo, especies como Bacillus megaterium destacan por su capacidad para producir giberelinas y citoquininas, hormonas reguladoras del crecimiento vegetal, que favorecen la elongación celular y el desarrollo de hojas en las plantas (Farias et al., 2022).
La aplicación de PGPR en campo para mejorar los síntomas del estrés abiótico bajo condiciones de sequía, salinidad y deficiencias nutricionales, demuestran que hay diferentes mecanismos fisiológicos que son modulados en las plantas (Riaz et al., 2021). La producción de fitohormonas involucradas en diferentes funciones que estimulan el crecimiento radicular, la síntesis de exopolisacáridos, la actividad de la enzima ACC desaminasa —que reduce los niveles de etileno asociados al estrés—; la acumulación de osmoprotectores como prolina y trehalosa; y la activación de enzimas antioxidantes como superóxido dismutasa y catalasa —que mitigan el daño oxidativo— son algunos ejemplos de dichos procesos (Glick, 2014; Greffe y Michiels, 2020; Nadeem et al., 2009; Timmusk et al., 2017).
De igual manera, se ha demostrado que la expresión génica de las plantas y los microorganismos se modula en respuesta a su interacción, a través de una comunicación bidireccional, que aporta en procesos de absorción de compuestos no asimilables por las plantas como nitrógeno (N), fósforo (P), potasio (K), cobre (C), magnesio (Mg), zinc (Zn) y calcio (Ca), entre otros (Adesemoye y Kloepper, 2009; Bhardwaj et al., 2014; Farias et al., 2022; Vessey, 2003).
La fijación biológica de nitrógeno, por ejemplo, ha sido de los mecanismos más estudiados en biofertilización, ya que aprovecha la capacidad de bacterias como Bradyrhizobium japonicum y Azospirillum brasilense para establecer simbiosis con las raíces de leguminosas y otros cultivos, al hacer la conversión del nitrógeno atmosférico en formas asimilables por las plantas (Bini et al., 2024; García et al., 2017). Este proceso es fundamental en la síntesis de proteínas, ácidos nucleicos y clorofila, participa en la regulación de genes asociados con la defensa y su deficiencia activa respuestas de estrés que limita la producción de los cultivos (Maeda et al., 2018; Masclaux-Daubresse et al., 2010; Sugliani et al., 2016). Un ejemplo de ello se presenta en cultivos de soya (Glycine max), donde un inoculante a base de Bradyrhizobium sp. permitió reducir la fertilización con compuestos nitrogenados y mejoró el rendimiento del cultivo (Kalinowski de Souza et al., 2018).
Otro elemento esencial para el crecimiento de las plantas que puede verse alterado por la pérdida de la estructura de los suelos es el fósforo. Diversas investigaciones han identificado microorganismos que solubilizan este elemento en cultivos de maíz (Zea mays), y ha llevado a incrementos de hasta un 15 % en el rendimiento, en comparación con suelos no inoculados (Lopes et al., 2021). En este contexto, soluciones basadas en bacterias como Bacillus subtilis y Pseudomonas fluorescens han demostrado una alta capacidad para solubilizar fósforo inorgánico y liberar formas biodisponibles en la rizosfera como iones ortofosfato, lo que favorece su absorción radicular (Bini et al., 2024; Galbieri et al., 2023; Jambhulkar y Sharma, 2012). Los reportes sobre la búsqueda de microorganismos que solubilizan este elemento para el uso agrícola sugieren una aplicación esencial, pues está implicado en procesos como la transferencia de energía, la señalización metabólica y la arquitectura radicular. Además, su deficiencia en plantas puede provocar retraso en la floración y menor calidad de los frutos, debido a la activación de rutas metabólicas asociadas al estrés (Bustos et al., 2010; Chiou y Lin, 2011; Rodríguez y Fraga, 1999).
El conjunto de estos mecanismos convierte a las PGPR en una herramienta prometedora para fortalecer la nutrición vegetal, la defensa frente a patógenos y la tolerancia al estrés abiótico en la agricultura, lo que reduce la necesidad de implementar insumos químicos que alteren las características fisicoquímicas y biológicas los suelos (Kalinowski de Souza et al., 2018; Lopes et al., 2021).
Estrategias de formulación de inoculantes microbianos
Una parte esencial de la investigación en bioinsumos agrícolas —además de la identificación de nuevas cepas prometedoras— se enfoca en desarrollar estrategias que mejoren la estabilidad y viabilidad de los microorganismos desde las etapas de producción hasta su aplicación en campo (Greffe y Michiels, 2020).
Para ello, se utilizan diversos mecanismos que suspenden la carga biológica en materiales compatibles, lo que permite mantener un metabolismo eficiente frente a las condiciones edafoclimáticas y de competencia que pueden ocurrir en el campo (Balla et al., 2022). Por tanto, una formulación adecuada juega un papel crucial en la supervivencia de los microorganismos, lo que influye en su eficacia para promover el crecimiento vegetal y biocontrol de patógenos (Cesari et al., 2024).
Los retos más importantes por resolver para mejorar la resistencia de los bioinsumos ante condiciones como la desecación, incluyen el desarrollo y optimización de formulaciones que minimicen el estrés osmótico y los daños en la membrana celular (Greffe y Michiels, 2020). Para abordar este desafío, se han propuesto diversas estrategias como la encapsulación en materiales como alginato (Vemmer y Patel, 2013). Esta tecnología consiste en inmovilizar las células dentro de matrices protectoras mientras se mantienen activas, y la carga biológica se libera de manera controlada en el ambiente para aumentar su estabilidad en condiciones adversas (Vemmer y Patel, 2013).
Entre las diversas técnicas de encapsulación encontradas se destaca el uso de biopolímeros, aspecto que ha cobrado gran relevancia en las formulaciones destinadas a la coencapsulación con metabolitos protectores y la formulación en micropartículas con capacidad de retención de humedad, útil para hongos, bacterias y algas (Balla et al., 2022; Rojas-Sánchez et al., 2022). La encapsulación ha demostrado ser eficiente prolongando la vida útil de los inoculantes en el campo y al proponerse como una de las metodologías más eficientes en la actualidad (Cesari et al., 2024; Farias et al., 2022; Vemmer y Patel, 2013).
Importancia del carrier en la formulación
Los carriers (o soporte) son sustancias inertes o biodegradables que actúan como vehículo y medio de protección para los microorganismos, y su eficacia depende de características específicas, como pH neutro, buena porosidad, alta capacidad de retención de agua y liberación controlada del inóculo (Vassilev et al., 2020). Estas sustancias contribuyen a la adhesión a las raíces y a la liberación gradual de los microorganismos en la rizosfera, ayudan a soportar la desecación, las temperaturas extremas, la competencia con la microbiota nativa y el mantenimiento de viabilidad durante el almacenamiento y la aplicación en cultivos (Bini et al., 2024). Todas estas características determinan su efectividad funcional en el ecosistema agrícola (Farias et al., 2022).
Carriers sólidos: estabilidad y mayor tiempo de almacenamiento
Los carriers sólidos son uno de los materiales ampliamente utilizados por su capacidad para proporcionar un entorno estable y proteger a los microorganismos de la desecación y el estrés ambiental (Bashan et al., 2014; Herrmann y Lesueur, 2013; Malusá et al., 2012). Entre los más reportados en aplicaciones de campo se encuentran la turba, el carbón activado, biochar, arcilla y residuos agrícolas. La alta capacidad de retención de humedad, protección y liberación controlada de los microorganismos en el suelo son algunas de las características de estos materiales (Bini et al., 2024).
El biochar es un carrier altamente efectivo para microorganismos debido a su gran superficie interna y porosidad, lo que mejora su estabilidad y absorción en el material (Lehmann y Joseph (2015); Malusá et al., 2012). Esto se debe a que la estructura porosa tridimensional compleja del biochar ofrece una multitud de microhábitats físicos que protegen a los microorganismos de condiciones como la desecación, la radiación UV y la depredación por parte de protozoos. Por otro lado, Bashan et al. (2014) señalaron que el carbón activado funciona como un soporte ideal en la formulación de bioinoculantes, ya que protege a los microorganismos gracias a su capacidad para retener agua. Además, su área superficial lo convierte en un refugio que amortigua los efectos de la fluctuación de la humedad y proporciona un microambiente estable durante periodos prolongados.
Otro carrier sólido que se señala en formulaciones de interés es la turba, un material orgánico compuesto por restos vegetales parcialmente descompuestos que se acumulan en ambientes acuáticos de baja oxigenación (Van der Heijden et al., 2016). Deaker et al. (2004) indicaron que proporciona un ambiente estable y favorable para la supervivencia de rizobacterias promotoras del crecimiento vegetal. Además, Bashan et al. (2014) señalaron que la turba es una opción ampliamente utilizada en la actualidad debido a su disponibilidad y efectividad en la estabilización de bioinoculantes; sin embargo, la disponibilidad y sostenibilidad han sido cuestionadas en algunos casos por ser extraída de turberas, ecosistemas únicos que tardan milenios en desarrollarse y que son grandes sumideros de carbono, reservorios de biodiversidad y reguladores hídricos (Clymo y Reed, 1996; Clymo et al., 1998; Joosten y Clarke, 2002; Yu, 2011).
Carriers líquidos: facilidad de aplicación, pero menor estabilidad
Los carriers líquidos, como soluciones acuosas, emulsiones y aceites vegetales, revelan ventajas en términos de facilidad de aplicación y compatibilidad con técnicas modernas de inoculación, como el recubrimiento de semillas y la aplicación foliar (Vio et al., 2025). Deaker et al. (2012) señalaron que las formulaciones líquidas presentan desafíos significativos debido a su susceptibilidad a la contaminación microbiana, lo que puede afectar la función del inoculante durante el almacenamiento. Dicha contaminación no solo reduce la concentración y viabilidad del microorganismo objetivo, sino que también introduce competidores o agentes patógenos, lo que compromete la seguridad y eficacia del producto.
Estudios recientes respaldan que los cambios en pH, temperatura y disponibilidad de nutrientes en medios líquidos pueden generar estrés fisiológico significativo en las células del inoculante, lo que reduce la viabilidad, limita la eficiencia de actividades metabólicas e incluso induce muerte celular (Allouzi et al., 2023; Pereira et al., 2023). Los efectos de las fluctuaciones térmicas en los carriers líquidos muestran alteraciones en las membranas celulares, y en consecuencia, la integridad y funcionalidad de las bacterias en el inoculante. Además, las variaciones extremas de pH inhiben la actividad enzimática, lo que acelera la pérdida de funcionalidad de las bacterias dentro del carrier. Estas condiciones ambientales provocan desorganización de la bicapa lipídica y desnaturalización de proteínas esenciales, lo que desestabiliza el inoculo (Rani et al., 2024). Por otro lado, la escasez o el desequilibrio de nutrientes también impiden el mantenimiento celular y la proliferación, lo que compromete la eficacia del producto en campo (Allouzi et al., 2023).
Con el fin de mitigar estos efectos, se identificó que el uso de aditivos como el glicerol y la sacarosa actúan como osmoprotectores, lo que estabiliza las membranas celulares y las proteínas frente a condiciones adversas como la deshidratación, estrés osmótico y las fluctuaciones de temperatura (Pereira et al., 2023). Al preservar la integridad celular y molecular, los microorganismos permanecen viables y funcionales, lo que influye en la vida útil y la eficacia de los bioinoculantes desde su producción hasta su aplicación en campo (Rani et al., 2024).
A pesar de sus limitaciones, la formulación líquida permite aplicaciones en la parte aérea de las plantas por su alta capacidad de dispersión, lo que favorece una mejor adhesión y absorción sobre superficies vegetales no subterráneas (Jambhulkar et al., 2012). Además, la distribución uniforme del inoculante beneficia el tratamiento de semillas antes de la siembra (Allouzi et al., 2023; Ma, 2019), en comparación con las soluciones sólidas, ya que ofrecen mayor versatilidad de uso sobre el sustrato (Pereira et al., 2023).
Carriers a base de biopolímeros: innovación en formulaciones sostenibles
El uso de biopolímeros como alginato, quitosano y carboximetilcelulosa en la encapsulación de microorganismos ha demostrado eficacia en la protección del estrés ambiental y favorecer su liberación controlada en la rizosfera. Estos materiales forman microcápsulas que mantienen la viabilidad microbiana y permiten una interacción sostenida con las raíces (John et al., 2010; Vassilev et al., 2020).
Recientemente, se ha observado una tendencia hacia formulaciones más complejas que integran metabolitos vegetales y compuestos bioadhesivos dentro de la misma cápsula, lo que mejora la colonización en los suelos y potencia los efectos beneficiosos sobre el crecimiento vegetal (Cesari et al., 2024). Esta evolución indica un cambio desde una función meramente protectora hacia formulaciones con múltiples capacidades bioactivas que mantienen la estabilidad en el almacenamiento, bajo diferentes condiciones edafoclimáticas y no compiten directamente con la microbiota nativa (Bashan et al., 2014; Balla et al., 2022; Clagnan et al., 2024; Čaušević et al., 2024; Malusá et al., 2012; dos Reis et al., 2024). El avance en las investigaciones sobre la capacidad de los carriers, así como sus combinaciones eficientes, nuevos materiales y compatibilidad de cepas será clave para producir mejores formulaciones y avanzar en la transición hacia el uso de bioinsumos sostenibles en campos agrícolas.
Encapsulación con exopolisacáridos (EPS)
Los exopolisacáridos (EPS) son macromoléculas secretadas por bacterias y hongos que pueden ser usadas como aditivos en formulaciones por sus propiedades estructurales y protectoras valiosas en el contexto agrícola para retener humedad y mejorar la comunicación planta microorganismo (Gauri et al., 2012; Ni et al., 2020). Su composición, basada en azúcares simples como glucosa, galactosa y ácido glucurónico, varía según el microorganismo, lo que influye directamente en su funcionalidad (Mouro et al., 2012).
Estos compuestos permiten además la formación de películas, geles y redes tridimensionales que favorecen la adhesión a superficies y protegen a los microorganismos frente a estrés abiótico, como la desecación y los cambios térmicos por la formación de matrices hidratadas que limitan la pérdida de agua y amortiguan el impacto del estrés osmótico (Gauri et al., 2012). Desde una perspectiva aplicada, la incorporación de EPS en inoculantes microbianos mejora la viabilidad celular durante el almacenamiento y posterior aplicación en campo. En el desarrollo de bioformulaciones es una tendencia creciente complementar la actividad de los microorganismos con otras moléculas que le facilitan procesos a las células para mejorar la estabilidad frente a la desecación, altas temperaturas y cambios de pH, entre otros aspectos (Farias et al., 2022).
Coencapsulación con metabolitos protectores
Un avance significativo en la formulación de inoculantes ha sido la exploración del concepto de coencapsulación, que implica la inclusión simultánea de microorganismos y sustancias bioactivas, como metabolitos vegetales o compuestos protectores dentro de una misma matriz portadora, lo que evidencia ser una estrategia prometedora para mejorar la estabilidad y la eficacia de los inoculantes (Rojas-Sánchez et al., 2022). Estudios recientes han evidenciado que la coencapsulación de microorganismos con compuestos bioactivos, como flavonoides, ácidos orgánicos y auxinas en matrices de biopolímeros mejora su tolerancia al estrés ambiental, favorece la colonización en la rizosfera y potencia la eficacia del inoculante (Bolan et al., 2023; Cesari et al., 2024; Vassilev et al., 2020). Estos compuestos no solo protegen a los microorganismos durante su aplicación, sino que también inducen respuestas beneficiosas en las plantas, lo que favorece la interacción planta-microorganismo y promueve el crecimiento vegetal (Morcillo et al., 2020).
La combinación de tecnologías como la encapsulación en biopolímeros, el uso de exopolisacáridos, la formulación en carriers adecuados y la coencapsulación con metabolitos ha mejorado la eficacia de los bioinoculantes (Cesari et al., 2024; Malusá et al., 2012; Vassilev et al., 2020). No obstante, los estudios resaltan la necesidad de optimizar estas estrategias para adaptarlas a diferentes condiciones agroecológicas y garantizar su efectividad a gran escala (Bashan et al., 2002; dos Reis et al., 2024).
La tabla 1 presenta las funciones clave de los distintos tipos de carrier empleados en la formulación de inoculantes microbianos. Cada uno de estos tiene un rol específico que contribuye a la eficacia y estabilidad de los inoculantes, y mejora la protección, distribución y viabilidad en aplicaciones agrícolas.
|
Tipo de carrier |
Ejemplo |
Función |
Referencia |
|---|---|---|---|
|
Sólidos |
Turba |
Alta capacidad de retención de agua y protección microbiana durante el almacenamiento. |
(Bashan et al., 2014; Deaker et al., 2012). |
|
Biochar |
Gran superficie porosa que mejora la adsorción de microorganismos y estabilidad a largo plazo. |
(Lehmann y Joseph, 2015; Malusá et al., 2012). |
|
|
Carbón activado |
Protege contra la desecación y facilita la liberación controlada de microorganismos. |
(Bashan et al., 2014; Herrmann y Lesueur, 2013). |
|
|
Líquidos |
Soluciones acuosas (agua + estabilizadores) |
Facilidad de aplicación y rápida activación en contacto con el suelo, pero con riesgo de contaminación microbiana. |
(Malusá et al.,2012; Deaker et al.,2012). |
|
Emulsiones de aceites vegetales |
Mejora la adhesión a las semillas y protege los microorganismos en tratamientos foliares. |
(Bashan et al.,2014; Vassilev et al.,2020). |
|
|
Geles poliméricos |
Proporciona retención de humedad y estabilidad en bioinoculantes líquidos. |
(Malusá et al.,2012; Vassilev et al.,2020). |
|
|
Aditivos |
Azúcares |
Protege los microorganismos del estrés osmótico y mejora la estabilidad en almacenamiento. |
(Bashan et al., 2014; Vemmer y Patel, 2013). |
|
Polímeros biodegradables (alginato, quitosano) |
Encapsulación y liberación controlada de microorganismos en el suelo. |
(Cesari et al., 2024; Malusá et al., 2012). |
|
|
Compuestos antimicrobianos (ácido propiónico, sorbato de potasio) |
Previene el crecimiento de microorganismos no deseados en carriers líquidos y mejora la estabilidad del producto. |
(Herrmann y Lesueur, 2013; Vassilev et al., 2020). |
Tabla 1. Principales funciones y tipos de carrier. Fuente: elaboración propia
Coencapsulación de microorganismos y metabolitos para mejorar la comunicación planta-microorganismo
La coencapsulación de microorganismos y metabolitos bioactivos representa una estrategia innovadora en la formulación de bioinoculantes, orientada a mejorar la viabilidad microbiana, optimizar la colonización radicular y potenciar la interacción entre planta-microorganismo (Gouda et al., 2018). La combinación de bacterias con metabolitos vegetales específicos dentro de las cápsulas ha demostrado incrementar su efectividad en diferentes aspectos, como mejorar la nutrición, mantener un pH estable en combinación con soluciones buffer y almacenar hormonas vegetales o metabolitos importantes que facilitan la comunicación entre el microorganismo y la planta huésped (Niu et al., 2022).
Esta estrategia se basa en la liberación de exudados radiculares que contienen compuestos bioactivos como ácidos orgánicos, flavonoides, azúcares y fitohormonas, que actúan como señales químicas, capaces de atraer y modular la actividad de microorganismos benéficos en la rizosfera (Cesari et al., 2024; Farias et al., 2022). Al incorporar estos compuestos en la formulación de inoculantes, se incrementa la eficacia de los biofertilizantes, biopesticidas y otros bioinsumos microbianos en el campo (Rojas-Sánchez et al., 2022).
Algunos de los experimentos que destacan lo anterior son la encapsulación de Rhizobium tropici en microcápsulas de alginato enriquecidas con flavonoides. Esto ha demostrado mejorar la nodulación en leguminosas por medio de la inducción de genes asociados a la fijación de nitrógeno (Farias et al., 2022). Por otro lado, la coencapsulación de Azospirillum brasilense con ácido indolacético (AIA) ha mostrado una mejora significativa en el crecimiento radicular y la absorción de agua en cultivos de maíz y trigo (Bini et al., 2024).
Tecnologías de coencapsulación y tipos de matrices utilizadas
La efectividad de la coencapsulación depende del tipo de biopolímero utilizado y de la técnica de microencapsulación aplicada (Rojas-Sánchez et al., 2022). Por ende, en la tabla 2 se hace un desglose de las tecnologías más utilizadas en la encapsulación de inoculantes microbianos.
|
Tipo de encapsulación |
Descripción |
Posibilidades de combinación |
Características |
Referencia |
|---|---|---|---|---|
|
Encapsulación en alginato de calcio |
Permite una liberación controlada de los microorganismos y metabolitos bioactivos en la rizosfera, y aumenta la colonización de las raíces. |
Puede combinarse con exopolisacáridos bacterianos o metabolitos vegetales para mejorar la estabilidad. |
Alta estabilidad en almacenamiento y buena viabilidad en el suelo, pero sensible a pH extremos. |
Cesari et al. (2024) |
|
Microencapsulación con quitosano |
Ofrece protección contra condiciones adversas y efectos antimicrobianos selectivos, lo que puede ayudar a controlar patógenos en el suelo sin afectar la viabilidad de las PGPR. |
Puede incluir compuestos antimicrobianos naturales o aceites esenciales para potenciar su efectividad contra patógenos. |
Biocompatible, biodegradable y con propiedades antimicrobianas selectivas. |
Farias et al. (2022) |
|
Nanopartículas de biopolímeros |
Representan una alternativa emergente para mejorar la estabilidad de los bioinoculantes y permitir una liberación gradual de compuestos bioactivos. |
Puede coencapsular microorganismos con enzimas, hormonas vegetales o nanopartículas de sílice. |
Aumenta la estabilidad en suelos degradados, permite liberación sostenida y mejora la absorción de nutrientes. |
Lopes et al. (2021) |
|
Encapsulación en emulsiones, pickering |
Utiliza partículas sólidas naturales como estabilizantes para mejorar la estabilidad de los bioinoculantes en condiciones ambientales difíciles. |
Puede usarse con proteínas, polisacáridos y surfactantes naturales para mejorar la dispersión y adhesión a raíces. |
Mejora la biodisponibilidad de bioinoculantes líquidos y la |
Niu et al. (2022) |
|
Encapsulación en matrices lipídicas |
Involucra la encapsulación en estructuras lipídicas como liposomas para mejorar la biodisponibilidad y la viabilidad de los microorganismos. |
Puede combinarse con aceites esenciales o fosfolípidos para optimizar la estabilidad y adhesión en la rizosfera. |
Proporciona alta protección contra la desecación, pero puede ser costosa en su producción. |
Chelliah et al. (2025) |
|
Coencapsulación de metabolitos bioactivos y microorganismos |
Asocia microorganismos con compuestos bioactivos naturales para mejorar su eficacia y favorecer una comunicación más eficiente con la planta huésped. |
Puede incluir hormonas vegetales, flavonoides, ácidos orgánicos o moléculas señalizadoras para estimular la colonización radicular. |
Mejora la interacción planta-microorganismo, incrementa la resistencia al estrés ambiental y favorece la bioestimulación. |
Szabados y Savoré (2010) |
Tabla 2. Tecnologías más utilizadas en la formulación de inoculantes microbianos. Fuente: elaboración propia.
Factores que afectan la eficiencia de formulaciones biológicas en aplicaciones de campo
Aunque las rizobacterias promotoras del crecimiento vegetal y otros microorganismos muestran alto potencial en la agricultura sostenible, su desempeño en campo puede verse afectado debido a factores de tipo biótico y abiótico como el estrés, la competencia con microbiota nativa y la variabilidad en las prácticas agrícolas (Greffe y Michiels, 2020; Herrmann y Lesueur, 2013). Frente a estas limitaciones, las estrategias de formulación han cobrado relevancia, ya que permiten mejorar la supervivencia, colonización y funcionalidad de los microorganismos en la rizosfera (Bini et al., 2024; Lopes et al., 2021).
Por su parte, la formulación del inoculante es un factor clave para su éxito en campo en condiciones agrícolas reales (Yahya et al., 2022). La selección del carrier y el método de formulación afectan la viabilidad del inoculante y su persistencia en el suelo (Rojas-Sánchez et al., 2022). Pastor-Bueis et al. (2019) describen que la combinación de carriers y estrategias de encapsulación pueden mejorar la estabilidad y eficacia de los bioinoculantes en condiciones agrícolas reales. Mientras que los carriers sólidos, como turba o biochar, ofrecen mayor estabilidad en aplicaciones durante el almacenamiento, los inoculantes líquidos presentan ventajas en términos de facilidad de aplicación, especialmente en tratamientos foliares y en sistemas de riego, pero presentan menor vida útil (Bini et al., 2024).
La encapsulación con alginato, quitosano o carboximetilcelulosa han demostrado mejorar la supervivencia de los microorganismos en campo al proporcionarles una barrera de protección contra la desecación y condiciones adversas (Cesari et al., 2024). La selección del carrier, ya sea encapsulación, formulaciones liquidas o sólidas, definen las características y el aspecto del producto como la adherencia y persistencia en las semillas, el modo de uso en la superficie de las hojas, aplicación en el suelo, la liberación de los microorganismos en el ambiente y la capacidad de establecerse y colonizar —en rizosfera, filósfera o tejidos internos de la planta— (Cesari et al., 2024; Vemmer y Patel, 2013; Vio et al., 2025).
En la tabla 3 se presenta una comparación entre inoculantes sólidos y líquidos, así como las principales ventajas y desafíos en términos de estabilidad, aplicación y eficacia en campo.
|
Aspecto |
Inoculantes líquidos |
Inoculantes sólidos |
|---|---|---|
|
Facilidad de aplicación |
Aplicación práctica mediante fertirriego o pulverización |
Requiere mezclado con el suelo o aplicación en semillas (Bashan et al., 2014). |
|
Estabilidad y vida útil |
Vida útil más corta, requiere estabilizantes (Pastor-Bueis et al., 2019). |
Mayor estabilidad y viabilidad durante almacenamiento prolongado |
|
Almacenamiento |
Mayor sensibilidad a cambios de temperatura y pH (Bashan et al., 2014). |
Menos afectado por cambios ambientales durante almacenamiento |
|
Disponibilidad de nutrientes |
Rápida disponibilidad de nutrientes para las plantas (Vassilev et al., 2020). |
Liberación más lenta pero sostenida de nutrientes |
|
Compatibilidad con suelos |
Menor estabilidad en suelos secos o con alta lixiviación (Pisarska y Pietr, 2015). |
Mayor persistencia en el suelo, adecuado para condiciones adversas |
|
Protección contra factores ambientales |
Menos protección contra desecación y radiación UV (Compant et al., 2019). |
Mejor protección contra desecación y temperaturas extremas |
|
Costo de producción |
Generalmente más |
Puede ser más costoso de producir por el uso de carriers específicos (Pisarska y Pietr, 2015). |
|
Riesgo de contaminación microbiana |
Mayor riesgo de proliferación de microorganismos no deseados |
Menor riesgo de contaminación microbiana debido a menor humedad |
Tabla 3. Diferencias entre inoculantes sólidos y líquidos. Fuente: elaboración propia.
En síntesis, los resultados de la revisión confirman que la eficacia de los inoculantes microbianos en campo es esencial para optimizar su aplicación y maximizar sus beneficios en la productividad agrícola. De igual manera, las condiciones edafoclimáticas desempeñan un papel crucial en la efectividad de PGPR, hongos y otros microorganismos aplicados en la agricultura, ya que afectan su desarrollo y su capacidad de interacción con las raíces. Factores como la temperatura del suelo y la humedad son determinantes para la actividad microbiana, su colonización radicular y la disponibilidad de nutrientes esenciales (Compant et al., 2019).
Temperatura
La temperatura tanto del suelo como del ambiente es uno de los factores más críticos que afectan la viabilidad y actividad metabólica de los microorganismos inoculados, puesto que las PGPR tienen rangos para su actividad metabólica y colonización radicular específicos (Kalinowski de Souza et al., 2018). Por ejemplo, temperaturas extremas —altas (>35 °C) o bajas (<10 °C)— pueden reducir su viabilidad y afectar su capacidad para fijar nitrógeno o solubilizar fósforo (Greffe y Michiels, 2020). Algunas especies, como Pseudomonas fluorescens, muestran una mayor tolerancia a temperaturas variables, mientras que Bradyrhizobium japonicum y Azospirillum brasilense requieren temperaturas moderadas para un crecimiento óptimo (Bini et al., 2024). De este comportamiento se puede inferir que no solo es importante tener cepas eficientes, sino que además se debe tener en cuenta que los microorganismos no tienen la capacidad de realizar sus funciones en todos los ambientes con la misma eficiencia, ya que sus funciones pueden causar la inactivación del inóculo. Por ejemplo, la temperatura es una limitante que debería ser conocida antes de realizar un proceso de fertilización u otra aplicación en un cultivo (Kalinowski de Souza et al., 2018).
Humedad del suelo
Los suelos secos limitan la movilidad de los microorganismos y su capacidad para colonizar las raíces, mientras que una saturación excesiva de agua reduce la aireación del suelo y genera condiciones anaeróbicas que pueden inactivar los inoculantes biológicos (Fahey et al., 2020). Estas condiciones reducen la actividad enzimática de los microorganismos del suelo, y esto afecta procesos clave como la fijación de nitrógeno y la solubilización de nutrientes por especies nativas (Chen et al., 2025). Así mismo, la saturación prolongada de agua restringe el intercambio gaseoso necesario para la actividad de algunos microorganismos presentes en bioinsumos (Farias et al., 2022). El anegamiento genera la proliferación de patógenos anaeróbicos, que causan enfermedades como pudrición de raíz, lo que compromete la salud de las plantas. Por otro lado, mediante procesos de competencia se desplazan cepas benéficas para los cultivos (Greffe y Michiels, 2020). Sin embargo, el uso de carriers con alta capacidad de retención hídrica o aislantes como biopolímeros o turba pueden mejorar la supervivencia de los inoculantes microbianos en suelos con variabilidad hídrica bajo condiciones edafoclimáticas variables (Cesari et al., 2024).
pH del suelo
El pH del suelo es un factor determinante que regula la disponibilidad de nutrientes y la actividad metabólica de microorganismos como las PGPR, perturba la viabilidad y capacidad de colonización en la rizosfera (Lopes et al., 2021). En suelos ácidos, la disponibilidad de macronutrientes como fósforo, calcio y magnesio puede afectar de forma negativa su fijación en formas insolubles con aluminio, hierro y calcio, lo que limita la absorción de las plantas (Greffe y Michiels, 2020). En suelos alcalinos, la solubilización de fosfatos y micronutrientes como hierro, zinc y manganeso se ve restringida, lo que puede afectar negativamente la nutrición vegetal (Bini et al., 2024).
Bacterias como Bacillus subtilis y Pseudomonas fluorescens muestran una notable capacidad de sobrevivir en un rango de pH de 5.0 a 9.0, lo que les permite adaptarse a diversas condiciones edáficas (Lopes et al., 2021). En contraste, microorganismos especializados en fijación biológica de nitrógeno, como Rhizoenbium y Bradyrhizobium, requieren suelos ligeramente ácidos a neutros (pH 6.0-7.0) para lograr una nodulación efectiva en leguminosas (Bini et al., 2024).
Para mejorar la eficacia de los inoculantes microbianos en suelos con pH extremo, se han implementado estrategias como el uso de enmiendas naturales, la selección de cepas adaptadas y el desarrollo de formulaciones con polímeros protectores (Malusá et al., 2012). Se ha reportado que soluciones convencionales incurren en la aplicación de cal agrícola o carbonato de calcio, utilizado para aumentar el pH en suelos ácidos, mientras que el azufre elemental o la materia orgánica pueden reducir la alcalinidad y mejorar la disponibilidad de nutrientes (Farias et al., 2022). La encapsulación de PGPR en biopolímeros tamponados, como el alginato de sodio combinado con buffers como fosfato o carbonato de calcio, constituye una estrategia efectiva para mantener un microambiente estable y favorable para los microorganismos (Jiménez-Arias et al., 2025). Aplicaciones de campo y ensayos experimentales en frijol, maíz y otros cultivos demuestran que los microorganismos formulados bajo esta estrategia mejoran el crecimiento vegetal al reducir el impacto del pH sobre la fisiología bacteriana, lo que prolonga su actividad benéfica en los cultivos. Además, se reporta que esta formulación incrementa la colonización de otros microorganismos en la rizosfera del maíz (Rojas-Sánchez et al., 2022).
Radiación ultravioleta (UV) y su impacto en la viabilidad microbiana
La radiación UV es un factor abiótico que puede afectar la supervivencia de los microorganismos aplicados en la superficie de las hojas y el suelo (Tripathi et al., 2017). Especies como Bacillus subtilis y Pseudomonas fluorescens pueden resistir eficientemente a esta radiación debido a la producción de pigmentos protectores y a la esporulación (Kalinowski de Souza et al., 2018). Es importante verificar la resistencia a la exposición UV de los microorganismos en los inoculantes antes de realizar la formulación, y elegir el mejor carrier o coadyuvante (Tripathi et al., 2017). Sin embargo, seleccionar especies resistentes a la radiación UV como Pseudomonas fluorescens junto a estrategias como encapsulación con nanopartículas de biopolímeros con capacidad de filtrado UV mejoran la eficiencia del bioinsumo y promueve el crecimiento de los microorganismos, los protege contra la degradación y maximiza su persistencia en el campo (Rojas-Sánchez et al., 2022).
En múltiples estudios se aborda a la lignina como un compuesto de interés para resistir a radiación UV, por ejemplo, Arora et al. (2018) generaron películas biodegradables a base de lignina, y encontraron un bloqueo de más del 90 % de la radiación. También se ha evaluado la lignina en nanofibras o nanopartículas, mostrando un excelente desempeño como barrera UV, con alta estabilidad térmica, resistencia mecánica y alta protección en rango UV (Lopes et al., 2021).
Interacción con microbiomas nativos del suelo
El suelo alberga una comunidad microbiana diversa que puede influir significativamente en la supervivencia y actividad de los inóculos microbianos (Pisarska y Pieter, 2015). La competencia con microorganismos nativos, el antagonismo con patógenos y la disponibilidad de nutrientes son factores que pueden alterar la eficacia de los inoculantes (Bashan et al., 2014; Herrmann y Lesueur, 2013).
En Colombia, los estudios sobre inoculación se han enfocado principalmente en cultivos de frijol común (Phaseolus vulgaris), y han evidenciado avances prácticos en la selección y evaluación de cepas microbianas adaptadas a condiciones locales. Además, se han identificado y caracterizado rizobios y otras rizobacterias promotoras del crecimiento que, al inocularse en semilla o en suelo, aumentan la nodulación, mejoran la fijación biológica de nitrógeno y, en muchos casos, incrementan el rendimiento del cultivo bajo condiciones de campo (Zambrano-Moreno et al., 2015). Además, se han desarrollado ensayos de bioestimulación combinada, en los cuales se aplican cepas simbióticas y PGPR con efectos sinérgicos sobre el vigor de plántula y la tolerancia a estrés abiótico (Yaadesh et al., 2023). Estos resultados destacan la importancia de utilizar inoculantes seleccionados regionalmente y de optimizar la formulación y la técnica de aplicación para asegurar resultados reproducibles en distintos suelos y climas del país.
No obstante, la introducción de inóculos microbianos en suelos con microbiomas establecidos puede resultar en baja colonización de la rizosfera, ya que las bacterias introducidas deben competir con poblaciones nativas por nichos ecológicos y recursos disponibles (Greffe y Michiels, 2020). Otro aspecto importante es la interacción con hongos y patógenos del suelo, algunas PGPR pueden ayudar a las plantas a resistir enfermedades mediante la producción de compuestos antimicrobianos y la inducción de resistencia sistémica (Petrillo et al., 2022; Glick, 2012). Sin embargo, en suelos con alta presencia de patógenos agresivos, su efectividad puede verse reducida al ser desplazados por los mismos (Backer et al., 2018; Lambers et al., 2009). Para mejorar la supervivencia en estos entornos, se han implementado estrategias como aumentar la cantidad de células en el volumen del inóculo para dar capacidad de competencia; además, se han desarrollado formulaciones como la coinoculación de múltiples cepas microbianas y la encapsulación en biopolímeros que favorece la persistencia en el suelo (Cesari et al., 2024).
Uno de los enfoques con más auge es la creación de consorcios microbianos denominados SynComs (Synthetic Communities en inglés), inoculaciones mixtas de al menos tres individuos diferentes que se elaboran a partir de bacterias, hongos o ambos (Clagnan et al., 2024; Čaušević et al., 2022). Las capacidades combinadas de cepas provenientes de ambientes y ecosistemas diferentes no nativos coexisten funcionalmente por compatibilidad e incluso generan sinergias (Petrillo et al., 2021). Otro tipo de consorcios son los NatComs, comunidades naturales extraídas o aisladas de un ambiente preexistente que mantienen sus funciones y pueden ser aprovechadas en aplicaciones agrícolas (Petrillo et al., 2022). El uso de consorcios bacterianos, ya sean sintéticos o naturales, son una alternativa que favorece el establecimiento, la resiliencia funcional y la capacidad competitiva de los microorganismos frente a patógenos, y además establece nuevos ambientes (Clagnan et al., 2024; Čaušević et al., 2022).
Compatibilidad de inóculos microbianos con insumos y prácticas agronómicas convencionales
El manejo agronómico desempeña un papel crucial en el éxito de los inoculantes biológicos en campo. Aunque su uso está en expansión, su adopción generalizada aún enfrenta limitaciones logísticas, de infraestructura y desarrollo (Rojas-Sánchez et al., 2022). Las prácticas como la fertilización, rotación de cultivos y uso de agroquímicos pueden impactar la viabilidad y efectividad de inóculos con PGPR y otros microorganismos (Bashan et al., 2014). Algunos estudios han demostrado que altas concentraciones de fertilizantes nitrogenados pueden inhibir la fijación biológica de nitrógeno, al reducir la efectividad de los inoculantes basados en Bradyrhizobium y Azospirillum. Sin embargo, el uso de los insumos convencionales y biológicos no es excluyente (Kalinowski de Souza et al., 2018). Estrategias como la combinación de fertilización parcial con productos de base biológica y la fertilización convencional han mostrado efectos sinérgicos, al mejorar la eficiencia en la absorción de nutrientes como nitrógeno y fósforo, lo que reduce la dependencia de fertilizantes sintéticos convencionales y permite una transición hacia prácticas agrícolas modernas (Lopes et al., 2021).
La diversificación de cultivos también favorece la actividad microbiana del suelo, al promover más interacciones microbianas, la persistencia y establecimiento de los inóculos biológicos (Rojas-Sánchez et al., 2022). Como señala Correa-Galeote (2018), la biodiversidad de bacterias endófitas en los cultivos de maíz varía según el entorno agroecológico, lo que sugiere que la diversificación de cultivos influya en la composición y estabilidad de las comunidades microbianas. En contraste, el uso de monocultivos y la labranza intensiva pueden interferir en la estructuración de estas comunidades, y además dificultar la colonización por parte de formulaciones biológicas (Farias et al., 2022; Vukicevich et al., 2016).
El uso de los insumos de base biológica es compatible con productos convencionales, acciones como la modificación de las concentraciones de insumos tradicionales como pesticidas, herbicidas o fertilizantes para combinarlos con estrategias más sostenibles reducen las cargas en los suelos protegiendo los microbiomas y al medio ambiente (Duque et al., 2024). Además, la implementación de estas estrategias en el campo permite hacer una transición gradual desde el uso de metodologías tradicionales, de modo que los agricultores puedan asimilar el cambio a nuevas tecnologías viendo de cerca a su implementación, funcionamiento y ventajas (Farias et al., 2022).
Conclusiones
Este análisis bibliográfico identificó estrategias de formulación determinantes para garantizar la viabilidad y eficacia de microorganismos benéficos, como las bacterias promotoras del crecimiento vegetal y algunos hongos en el ámbito de la agricultura sostenible. Su uso representa una alternativa frente a la pérdida de fertilidad de los suelos, el uso excesivo de agroquímicos y los desafíos del cambio climático. Sin embargo, su desempeño en campo se ve condicionado por múltiples factores edafoclimáticos que comprometen su estabilidad y funcionalidad.
La encapsulación microbiana se destaca como una de las metodologías más robustas y eficientes, ya que permite conservar la carga biológica y controlar la liberación del inoculante. Esta estrategia puede complementarse con portadores (carriers) y coadyuvantes como biopolímeros, fitohormonas, enzimas o agentes protectores contra la radiación UV, para adaptar la formulación a diferentes condiciones del suelo o clima. Además, se evidencia el potencial de los consorcios microbianos y comunidades sintéticas, una de las perspectivas más innovadoras en la investigación de bioinoculantes, al crear un entorno más saludable para las plantas. El diseño de estas comunidades para que interactúen de manera sinérgica ofrece una gran ventaja, al adaptarse mejor a las condiciones locales y maximizar el rendimiento de las plantas en condiciones específicas. No obstante, la investigación en formulación de consorcios requiere más profundización.
Para realizar aplicaciones de estas formulaciones en campo es fundamental considerar aspectos como la compatibilidad entre el inoculante y la especie vegetal, la forma de aplicación (sólida o líquida), la tolerancia a factores abióticos como la temperatura o la radiación UV y la estabilidad durante el almacenamiento, ya que no todos los inoculantes tienen el mismo efecto sobre todas las plantas. Además, el éxito de estas tecnologías no depende solo de su formulación, sino también del acompañamiento técnico, la capacitación de los agricultores y el respaldo institucional que facilite su adopción.
Finalmente, las formulaciones no deben concebirse como un proceso aislado, sino como una estrategia que debe considerar tanto las condiciones del ecosistema agrícola, como el comportamiento de los microorganismos. La inversión en investigación y desarrollo, así como la articulación con el sector productivo, será clave para consolidar estas tecnologías como herramientas viables, eficaces y sostenibles en los sistemas agrícolas contemporáneos.
Referencias
Adesemoye, A. O. y Kloepper, J. W. (2009). Plant–microbe interactions in enhanced fertilizer-use efficiency. Applied Microbiology and Biotechnology, 85(1), 1–12. https://doi.org/10.1007/s00253-009-2196-0
Alekseeva, L. I. y Osemwegie, O. O. (2020). Exopolysaccharides from bacteria and fungi: current status and perspectives in Africa. Heliyon, 6(6), e04205. https://doi.org/10.1016/j.heliyon.2020.e04205
Allouzi, M. M. A., Supramaniam, C. V., Chong, S. y Singh, A. (2023). Liquid biofertilizers as a sustainable solution for agriculture: Challenges and opportunities. Heliyon, 8(12), e12609. https://doi.org/10.1016/j.heliyon.2022.e12609
Arora, N. K., Fatima, T., Mishra, I., Verma, M., Mishra, J. y Mishra V. (2018). Environmental sustainability: challenges and viable solutions. Environmental Sustainability, 1(4), 309–340. https://doi.org/10.1007/s42398-018-00038-w
Backer, R., Rokem, J. S., Ilangumaran, G., Lamont, J., Praslickova, D., Ricci, E. y Smith, D. L. (2018). Plant growth-promoting rhizobacteria: Context, mechanisms of action, and roadmap to commercialization of biostimulants for sustainable agriculture. Frontiers in Plant Science, 9, 1473. https://doi.org/10.3389/fpls.2018.01473
Balla, A., Silini, A., Cherif-Silini, H., Chenari Bouket, A., Alenezi, F. N. y Belbahri, L. (2022). Recent advances in encapsulation techniques of plant growth-promoting microorganisms and their prospects in the sustainable agriculture. Applied Sciences, 12(18), 9020. https://doi.org/10.3390/app12189020
Bashan, Y., de-Bashan, L. E., Prabhu, S. R. y Hernandez, J. P. (2014). Advances in plant growth-promoting bacterial inoculant technology: Formulations and practical perspectives (1998–2013). Plant and Soil, 378, 1–33.
Bashan, Y., Hernández, J. P., Leyva, L. A. y Bacilio, M. (2002). Alginate microbeads as inoculant carriers for plant growth-promoting bacteria. Biology and Fertility of Soils, 35, 359–368. https://doi.org/10.1007/s00374-002-0481-5
Basu, A., Prasad, P., Das, S. N., Kalam, S., Sayyed, R. Z., Reddy, M. S., El-Enshasy, H. A. y Santoyo, G. (2021). Plant growth promoting rhizobacteria (PGPR) as green bioinoculants: Recent developments, constraints, and prospects. Sustainability, 13(3), 1140. https://doi.org/10.3390/su13031140
Bhardwaj, D., Ansari, M. W., Sahoo, R. K. y Tuteja, N. (2014). Biofertilizers function as key player in sustainable agriculture by improving soil fertility, plant tolerance and crop productivity. Microbial Cell Factories, 13, 66. https://doi.org/10.1186/1475-2859-13-66
Bini, D., Mattos, B.B., Figueiredo, J. E. F., dos Santos, F. C., Marriel, I. E., dos Santos, C. A. y de Oliveira-Paiva, C. A. (2024). Parameter evaluation for developing phosphate-solubilizing Bacillus inoculants. Brazilian Journal of Microbiology, 55(737–748).
Bolan, S., Hou, D., Wang, L., Hale, L. E., Egamberdieva, D., Tammeorg, P., Li, R., Wang, B., Xu, J., Wang, T., Sun, H., Padhye, L. P., Wang, H., Siddique, K., Rinklebe, J., Kirkham, M. y Bolan, N. (2023). The potential of biochar as a microbial carrier for agricultural and environmental applications. Science of The Total Environment, 886, 163968. https://doi.org/10.1016/j.scitotenv.2023.163968
Bustos, R., Castrillo, G., Linhares, F., Puga, M. I., Rubio, V., Pérez-Pérez, J. y Leyva, A. (2010). A central regulatory system largely controls transcriptional activation and repression responses to phosphate starvation in Arabidopsis. PLoS Genetics, 6(9), e1001102. https://doi.org/10.1371/journal.pgen.1001102
Čaušević, S., Dubey, M., Morales, M., Salazar, G., Sentchilo, V., Carraro, N., Ruscheweyh, H.-J., Sunagawa, S. y van der Meer, J. R. (2024). Niche availability and competitive loss by facilitation control proliferation of bacterial strains intended for soil microbiome interventions. Nature Communications, 15(1), 2557. https://doi.org/10.1038/s41467-024-46933-1
Cesari, A. B., Castilla Marín, V. E., Nieva Muratore, L., Paulucci, N. S. y Dardanelli, M. S. (2024). New inoculation strategy for legume based on Rhizobium-metabolite co-encapsulation. En Medina, C., López-Baena, F.J. (Eds.). Methods in Molecular Biology, Springer Protocols y Humana Press (pp. 261–272).
Chelliah, R., Rubab, M., Vijayalakshmi, S., Karuvelan, M., Barathikannan, K. y Oh, D. H. (2025). Liposomes for drug delivery: classification, therapeutic applications, and limitations. Next Nanotechnology, 8, 100209. https://doi.org/10.1016/j.nxnano.2025.100209
Chen, Y., Feng, S., Liu, Q., Kang, D. y Zou, S. (2025). Drought Modulates Root–Microbe Interactions and Functional Gene Expression in Plateau Wetland Herbaceous Plants. Plants, 14(15), 2413. https://doi.org/10.3390/plants14152413
Chiou, T. J. y Lin, S. I. (2011). Signaling network in sensing phosphate availability in plants. Annual Review of Plant Biology, 62, 185–206. https://doi.org/10.1146/annurev-arplant-042110-103849
Clagnan, E., Costanzo, M., Visca, A., Di Gregorio, L., Tabacchioni, S., Colantoni, E., Sevi, F., Sbarra, F., Bindo, A., Nolfi, L., Magarelli, R. A., Trupo, M., Ambrico, A., Bevivino, A. y Bevilacqua, C. (2024). Culturomics- and metagenomics-based insights into soil microbial consortia: From natural communities to synthetic application. Frontiers in Microbiology, 15, 1473666. https://doi.org/10.3389/fmicb.2024.1473666
Clymo, R. S. y Reed, A. M. (1996). Growth in ombrotrophic peat bogs in the English Lake District. Journal of Ecology, 84(4), 741–754. https://doi.org/10.2307/2261473
Clymo, R. S., Turunen, J. y Tolonen, K. (1998). Carbon accumulation in peatlands: Rates, mechanisms, and climatic controls. Oikos, 81(2), 368–388. https://doi.org/10.2307/3547057
Compant, S., Samad, A., Faist, H. y Sessitsch, A. (2019). A review on the plant microbiome: Ecology, functions, and emerging trends in microbial application. Journal of Advanced Research, 19, 29–37. https://doi.org/10.1016/j.jare.2019.03.004
Correa-Galeote, D., Bedmar, E. J. y Arone, G. J. (2018). Maize endophytic bacterial diversity as affected by soil cultivation history. Frontiers in Microbiology, 9, 484. https://doi.org/10.3389/fmicb.2018.00484
dos Reis, G. A., Martínez-Burgos, W. J., Pozzan, R., Pastrana Puche, Y., Ocán-Torres, D., de Queiroz Fonseca Mota, P., Rodrigues, C., Lima Serra, J., Scapini, T., Karp, S. G. y Soccol, C. R. (2024). Comprehensive Review of Microbial Inoculants: Agricultural Applications, Technology Trends in Patents, and Regulatory Frameworks. Sustainability, 16(19), 8720. https://doi.org/10.3390/su16198720
Duque, T. S., Pinheiro, R. A., Souza, I. M., Silva, G. G., Soares, M. A. y Dos Santos, J. B. (2024). Herbicides and bio-inputs: Compatibility and challenges for sustainable agriculture. Chemosphere, 369, 143878. https://doi.org/10.1016/j.chemosphere.2024.143878
Fahey, C., Koyama, A., Antunes, P. M., Dunfield, K. y Flory, S. L. (2020). Plant communities mediate the interactive effects of invasion and drought on soil microbial communities. The ISME Journal, 14(6), 1396–1409. https://doi.org/10.1038/s41396-020-0614-6
Farias, T. P., Castro, E. M., Tangerina, M. M. P., Rocha, C. Q., Bezerra, C. W. B. y Moreira, F. M. (2022). Rhizobia exopolysaccharides: promising biopolymers for use in the formulation of plant inoculants. Brazilian Journal of Microbiology, 53(1843–1856).
Food and Agriculture Organization of the United Nations [FAO]. (2022). Bioinsumos: Oportunidades de inversión en América Latina. FAO. https://openknowledge.fao.org/server/api/core/bitstreams/6f0feb21-441d-4662-aed5-03085a951d90/content
Food and Agriculture Organization of the United Nations [FAO] y Intergovernmental Technical Panel on Soils [ITPS]. (2015). Status of the world’s soil resources (SWSR): Main report. Roma: Food and Agriculture Organization of the United Nations. https://openknowledge.fao.org/3/i5199e/i5199e.pdf
Galbieri, R., de Oliveira, J. A., Negri, B. F., Boldt, A. S., Rizzi, U. S. y Belot, J. L. (2023). Bacillus subtilis as growth-promoting rhizobacteria co-inoculated on Bradyrhizobium-treated soybean seeds in the planting furrow. Revista Ceres, 70(6), e70601. https://doi.org/10.1590/0034-737X202370060001
García, M. M., Pereira, L. C., Braccini, A. L., Angelotti, P., Suzukawa, A. K., Marteli, D. C. y Dametto, I. B. (2017). Effects of Azospirillum brasilense on growth and yield compounds of maize grown at nitrogen-limiting conditions. Revista de Ciências Agrárias, 40(2), 353-362. https://doi.org/10.19084/RCA16101
Gauri, S.S., Mandal, S.M. y Pati, B.R. (2012). Impact of Azotobacter exopolysaccharides on sustainable agriculture. Applied Microbiology and Biotechnology, 95, 331–338. https://doi.org/10.1007/s00253-012-4159-0
Glick, B. R. (2012). Plant growth-promoting bacteria: mechanisms and applications. Scientifica, 2012(1), 963401. https://doi.org/10.6064/2012/963401
Glick, B. R. (2014). Bacteria with ACC deaminase can promote plant growth and help to feed the world. Microbiological Research, 169(1), 30–39. https://doi.org/10.1016/j.micres.2013.09.009
Gouda, S., Kerry, R. G., Das, G., Paramithiotis, S., Shin, H.-S. y Patra, J. K. (2018). Revitalization of plant growth-promoting rhizobacteria for sustainable development in agriculture. Microbiological Research, 206, 131–140. https://doi.org/10.1016/j.micres.2017.08.016
Greffe, V. R. G. y Michiels, J. (2020). Desiccation-induced cell damage in bacteria and the relevance for inoculant production. Applied Microbiology and Biotechnology, 104, 1–12.
Herrmann, L. y Lesueur, D. (2013). Challenges of formulation and quality of biofertilizers for successful inoculation. Applied Microbiology and Biotechnology, 97(20), 8859–8873.
Hungria, M., Loureiro, M. F., Mendes, I. C., Campo, R. J. y Graham, P. H. (2005). Inoculant preparation, production and application. En Nitrogen fixation in agriculture, forestry, ecology, and the environment (pp. 223-253). Dordrecht: Springer Netherlands. https://doi.org/10.1007/1-4020-3544-6_11
Instituto de Hidrología, Meteorología y Estudios Ambientales [Ideam], Corporación Autónoma Regional de Cundinamarca [CAR] y Universidad de Ciencias Aplicadas y Ambientales [U.D.C.A.]. (2017). Protocolo para la identificación y evaluación de la degradación de suelos por salinización. https://observatorio.epacartagena.gov.co/protocolo-para-la-identificacion-y-evaluacion-de-la-degradacion-de-suelos-por-salinizacion/
Jambhulkar, P. P. y Sharma, P. (2012). Comparative survivability of Pseudomonas fluorescens RRb-11 in different carriers and rhizosphere. The Bioscan, 7(3), 507–512. https://thebioscan.com/index.php/pub/article/view/1082
Jiménez-Arias, D., Morales-Sierra, S., García-García, A.L., Herrera, A.J., Pérez Schmeller, R., Suárez, E., Santana-Mayor, Á., Silva, P., Borges, J.P. y Pinheiro de Carvalho, M.Â.A. (2025). Alginate Microencapsulation as a Tool to Improve Biostimulant Activity Against Water Deficits. Polymers, 17(12), 1617. https://doi.org/10.3390/polym17121617
John, R. P., Tyagi, R. D., Brar, S. K., Surampalli, R. Y. y Prévost, D. (2010). Bio-encapsulation of microbial cells for targeted agricultural delivery. Critical Reviews in Biotechnology, 31(3), 211–226. https://doi.org/10.3109/07388551.2010.513327
Joosten, H. y Clarke, D. (2002). Wise Use of Mires and Peatlands: Background and Principles Including a Framework for Decision Making. International Mire Conservation Group (IMCG) and International Peat Society (IPS).
Kalinowski de Souza, G., de Farias, C. H., de Oliveira Mendes, G., Moreira, F. M. S. y Sampaio, J. A. L. (2019). Soybean inoculants in Brazil: An overview of quality control. Brazilian Journal of Microbiology, 50(1), 205–211. https://doi.org/10.1007/s42770-018-0028-z
Lambers, H., Mougel, C., Jaillard, B. y Hinsinger, P. (2009). Plant-microbe-soil interactions in the rhizosphere: an evolutionary perspective. Plant and Soil, 321(1), 83-115. https://doi.org/10.1007/s11104-009-0042-x
Lehmann, J. y Joseph, S. (2015). Biochar for environmental management: Science, technology and implementation. Routledge.
Li, H., Nian, J., Fang, S., Guo, M., Huang, X., Zhang, F., ... y Ma, X. (2022). Regulation of nitrogen starvation responses by the alarmone (p) ppGpp in rice. Journal of Genetics and Genomics, 49(5), 469-480. https://doi.org/10.1016/j.jgg.2022.02.006
Lopes, M. J. D. S., Dias-Filho, M. B. y Gurgel, E. S. C. (2021). Successful plant growth-promoting microbes: inoculation methods and abiotic factors. Frontiers in Sustainable Food Systems, 5, https://doi.org/10.3389/fsufs.2021.606454
Lugtenberg, B. y Kamilova, F. (2009). Plant-growth-promoting rhizobacteria. Annual Review of Microbiology, 63, 541–556. https://doi.org/10.1146/annurev.micro.62.081307.162918
Ma, Y. (2019). Seed coating with beneficial microorganisms for precision agriculture. Biotechnology Advances, 37(7), 107423. https://doi.org/10.1016/j.biotechadv.2019.107423
Malusá, E., Pinzari, F. y Canfora, L. (2016). Efficacy of biofertilizers: challenges to improve crop production. En D. P. Singh, H. B. Singh y R. Prabha (Eds.), Microbial Inoculants in Sustainable Agricultural Productivity (pp. 17-40). Springer. https://doi.org/10.1007/978-81-322-2644-4_2
Malusá, E., Sas-Paszt, L. y Ciesielska, J. (2012). Technologies for beneficial microorganisms inocula used as biofertilizers. The Scientific World Journal, 2012(1), 491206.
Masclaux-Daubresse, C., Daniel-Vedele, F., Dechorgnat, J., Chardon, F., Gaufichon, L. y Suzuki, A. (2010). Nitrogen uptake, assimilation and remobilization in plants: challenges for sustainable and productive agriculture. Annals of Botany, 105(7), 1141–1157. https://doi.org/10.1093/aob/mcq028
Moher, D., Liberati, A., Tetzlaff, J., Altman, D. G. y The PRISMA Group (2009). Preferred reporting items for systematic reviews and meta-analyses: The PRISMA statement. PLoS Medicine, 6(7), e1000097. https://doi.org/10.1371/journal.pmed.1000097
Montgomery, D. R. (2007). Soil erosion and agricultural sustainability. PNAS, 104(33), 13268–13272. https://doi.org/10.1073/pnas.0611508104
Morcillo, R. J. L. y Manzanera, M. (2021). The effects of plant-associated bacterial exopolysaccharides on plant abiotic stress tolerance. Metabolites, 11(6), 337. https://doi.org/10.3390/metabo11060337
Mosier, S., Córdova, S. C. y Robertson, G. P. (2021). Restoring soil fertility on degraded lands to meet food, fuel, and climate security needs via perennialization. Frontiers in Sustainable Food Systems, 5, 706142. https://doi.org/10.3389/fsufs.2021.706142
Mouro, C., Gomes, A. P. y Gouveia, I. C. (2024). Microbial exopolysaccharides: structure, diversity, applications, and future frontiers in sustainable functional materials. Polysaccharides, 5(3), 241-287. https://doi.org/10.3390/polysaccharides5030018
Nadeem, S. M., Zahir, Z. A., Naveed, M. y Arshad, M. (2009). Rhizobacteria containing ACC-deaminase confer salt tolerance in maize grown on salt-affected fields. Canadian Journal of Microbiology, 55(11), 1302-1309. https://doi.org/10.1139/W09-092
Ni, B., Xiao, L., Lin, D., Zhang, T. L., Zhang, Q., Liu, Y., ... y Zhu, Y. G. (2025). Increasing pesticide diversity impairs soil microbial functions. Proceedings of the National Academy of Sciences, 122(2), e2419917122. https://doi.org/10.1073/pnas.2419917122
Niu, B., Chen, H., Wu, W., Fang, X., Mu, H., Han, Y. y Gao, H. (2022). Co-encapsulation of chlorogenic acid and cinnamaldehyde essential oil in Pickering emulsion stabilized by chitosan nanoparticles. Food Chemistry: X, 14(30), 100312.
O’Callaghan, M., Ballard, R. A. y Wright, D. (2022). Soil microbial inoculants for sustainable agriculture: Limitations and opportunities. Soil Use and Management, 38(3), 1340–1369. https://doi.org/10.1111/sum.12811
Panagos, P., Meusburger, K., Van Liedekerke, M., Alewell, C., Hiederer, R. y Montanarella, L. (2014). Assessing soil erosion in Europe based on data collected through a European network. Soil Science and Plant Nutrition, 60(1), 15-29. https://doi.org/10.1080/00380768.2013.835701
Pastor-Bueis, R., Sánchez-Cañizares, C., James, E. K. y González-Andrés, F. (2019). Formulation of a highly effective inoculant for common bean based on an autochthonous elite strain of Rhizobium leguminosarum bv. phaseoli, and genomic-based insights into its agronomic performance. Frontiers in Microbiology, 10, 2724. https://doi.org/10.3389/fmicb.2019.02724
Pereira, J. F., Oliveira, A. L. M., Sartori, D., Yamashita, F. y Mali, S. (2023). Perspectives on the Use of Biopolymeric Matrices as Carriers for Plant-Growth Promoting Bacteria in Agricultural Systems. Microorganisms, 11(2), 467. https://doi.org/10.3390/microorganisms11020467
Petrillo, C., Vitale, E., Ambrosino, P., Arena, C. y Isticato, R. (2022). Plant Growth-Promoting Bacterial Consortia as a Strategy to Alleviate Drought Stress in Spinacia oleracea. Microorganisms, 10(9), 1798. https://doi.org/10.3390/microorganisms10091798
Pisarska, K. y Pietr, S. J. (2015). Biodiversity of dominant cultivable endophytic bacteria inhabiting tissues of six different cultivars of maize (Zea mays L. ssp. mays) cropped under field conditions. Polish Journal of Microbiology, 64(2), 163–170. https://pubmed.ncbi.nlm.nih.gov/26373177/
Rani, N., Maiti, A. y Daschakraborty, S. (2024). Comparative study of molecular mechanisms of sucrose & trehalose mediated protection and stabilization of Escherichia coli lipid membrane during desiccation. Chemistry Physics Impact, 8, 100645. https://doi.org/10.1016/j.chphi.2024.100645
Riaz, U., Murtaza, G., Anum, W., Samreen, T., Sarfraz, M. y Nazir, M. Z. (2021). Plant growth-promoting rhizobacteria (PGPR) as biofertilizers and biopesticides. En K. R. Hakeem, A. M. Al-Ahmad y S. A. Hakeem (Eds.), Microbiota and Biofertilizers (pp. 181–196). Springer Nature. https://doi.org/10.1007/978-3-030-48771-3_11
Rodríguez, H. y Fraga, R. (1999). Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnology Advances, 17(4–5), 319–339. https://doi.org/10.1016/S0734-9750(99)00014-2
Rojas-Sánchez, B., Guzmán-Guzmán, P., Morales-Cedeño, L. R., Orozco-Mosqueda, M. d. C., Saucedo-Martínez, B. C., Sánchez-Yáñez, J. M., Fadiji, A. E., Babalola, O. O., Glick, B. R. y Santoyo, G. (2022). Bioencapsulation of Microbial Inoculants: Mechanisms, Formulation Types and Application Techniques. Applied Biosciences, 1(2), 198–220.
Saberi-Riseh, R., Skorik, Y. A., Thakur, V. K., Moradi-Pour, M., Tamanadar, E. y Noghabi, S. S. (2021). Encapsulation of plant biocontrol bacteria with alginate as a main polymer material. International Journal of Molecular Sciences, 22(20), 11165. https://doi.org/10.3390/ijms222011165
Stephens, J. H. G. y Rask, H. M. (2000). Inoculant production and formulation. Field Crops Research, 65(2–3), 249-258. https://doi.org/10.1016/S0378-4290(99)00090-8
Szabados, L. y Savouré, A. (2010). Proline: a multifunctional amino acid. Trends in Plant Science, 15(2), 89–97.
Timmusk, S., Behers, L., Muthoni, J., Muraya, A. y Aronsson, A.C. (2017). Perspectives and challenges of microbial application for crop improvement. Frontiers in Plant Science, 8, 49. https://doi.org/10.3389/fpls.2017.00049
Tripathi, D. K., Singh, S., Singh, V. P., Prasad, S. M., Dubey, N. K. y Chauhan, D. K. (2017). Silicon nanoparticles more effectively alleviate UV-B stress than silicon in wheat (Triticum aestivum) seedlings. Plant Physiology and Biochemistry, 110, 70–81. https://doi.org/10.1016/j.plaphy.2016.06.026
Van der Heijden, M. G., de Bruin, S., Luckerhoff, L., van Logtestijn, R. S. y Schlaeppi, K. (2016). A widespread plant–fungal–bacterial symbiosis promotes plant biodiversity, plant nutrition and seedling recruitment. ISME Journal, 10(2), 389–399. https://doi.org/10.1038/ismej.2015.120
Vassilev, N., Vassileva, M., Martos, V., García del Moral, L. F., Kowalska, J., Tylkowski, B. y Malusá, E. (2020). Formulation of microbial inoculants by encapsulation in natural polysaccharides: Focus on beneficial properties of carrier additives and derivatives. Frontiers in Plant Science, 11, 270. https://doi.org/10.3389/fpls.2020.00270
Vemmer, M. y Patel, A. V. (2013). Review of encapsulation methods suitable for microbial biological control agents. Biological Control, 67(3), 380–389.
Vessey, J. K. (2003). Plant growth promoting rhizobacteria as biofertilizers. Plant and Soil, 255, 571–586. https://doi.org/10.1023/A:1026037216893
Vio, S. A., Martínez Sbrancia, C., Gortari, C., Galar, M. L. y Luna, M. F. (2025). Inoculation of microorganisms into the soil and rhizosphere. En D. Dharumadurai y A. Sankara Narayanan (Eds.), Plant Microbiome Engineering, Methods and Protocols in Food Science. Springer, Humana Press.
Vukicevich, E., Lowery, T., Bowen, P., Úrbez-Torres, J. R. y Hart, M. (2016). Cover crops to increase soil microbial diversity and mitigate decline in perennial agriculture. A review. Agronomy for Sustainable Development, 36(5), 48. https://doi.org/10.1007/s13593-016-0385-7
Wei, X., Xie, B., Wan, C., Song, R., Zhong, W., Xin, S. y Song, K. (2024). Enhancing soil health and plant growth through microbial fertilizers: Mechanisms, benefits, and sustainable agricultural practices. Agronomy, 14(3), 609. https://doi.org/10.3390/agronomy14030609
Yaadesh, S., Tomar, G. S., Kaushik, R., Prasanna, R. y Grover, M. (2023). Azospirillum–Bacillus associations: synergistic effects on in vitro PGP traits and growth of pearl millet at early seedling stage under limited moisture conditions. Biotech, 13(3), 90. https://doi.org/10.1007/s13205-023-03503-4
Yahya, M., Rasul, M., Sarwar, Y., Suleman, M., Tariq, M., Hussain, S. Z., ... y Yasmin, S. (2022). Designing synergistic biostimulants formulation containing autochthonous phosphate-solubilizing bacteria for sustainable wheat production. Frontiers in Microbiology, 13, 889073.
Ye, Y., Wang, Z., Zhang, H. y Li, X. (2024). Biofuel production for circular bioeconomy: Present status and future perspectives. Science of the Total Environment, 964, 174482. https://doi.org/10.1016/j.scitotenv.2024.172863
Yu, Z. (2011). Holocene carbon flux histories of the world’s peatlands: Global carbon-cycle implications: Global carbon-cycle implications. The Holocene, 21(5), 761-774. https://doi.org/10.1177/0959683610386982
Zambrano-Moreno, D. C., Ramón-Rodríguez, L. F., Van Strahlen-Pérez, M. y Bonilla-Buitrago, R. R. (2015). Industria de bioinsumos de uso agrícola en Colombia / Bioinoculants industry for agricultural use in Colombia. Revista UDCA: Actualidad & Divulgación Científica, 18(1), 59-67. https://doi.org/10.31910/rudca.v18.n1.2015.445
Zuffo, A. M., Rezende, P. M., Bruzi, A. T., Oliveira, N. T., Soares, I. O., Neto, G. F. G., Cardillo, B. E. S. y Silva, L. O. (2015). Co-inoculation of Bradyrhizobium japonicum and Azospirillum brasilense in the soybean crop. Revista de Ciências Agrárias, 87-93. https://doi.org/10.19084/rca.16873
* Licenciado en Biología. Profesor, investigador, candidato a doctor en Ciencias Biológicas de la Universidad de los Andes. Contribución: metodología y resultados con énfasis en fitopatología y microbiología agrícola. w.rodrigueze@uniandes.edu.co ORCID: https://orcid.org/0009-0001-0723-3179
** Licenciada en Biología. Profesional contratista del Ministerio de Ambiente y Desarrollo Sostenible. Contribución: resultados, construcción de base de datos para el manuscrito. cpmanquilloh@unincca.edu.co ORCID: https://orcid.org/0009-0002-1546-7933
*** Licenciada en Biología. Profesora de Biología. Contribución: elaboración de la introducción y conclusiones. laballesterosg@unincca.edu.co ORCID: https://orcid.org/0009-0004-1772-1645
1 Se comparten los datos abiertos a través de las galeradas del artículo.
