
Intercambio gaseoso de especies agrícolas nativas de La Mojana ante el aumento de temperatura y de CO2i
Anthony Ariza-Gonzálezii
Universidad de Córdoba (Colombia)
Alfredo Jarma-Orozcoiii
Universidad de Córdoba (Colombia)
Enrique Combatt-Caballeroiv
Universidad de Córdoba (Colombia)
Juan Carlos Guzmán-Castrov
Universidad de Córdoba (Colombia)
Luis Rodríguez-Páezvi
Universidad de Córdoba (Colombia)
Juan Jaraba-Navasvii
Universidad de Córdoba (Colombia)
Wilber Ramírez-Campoviii
Programa de Naciones Unidas para el Desarrollo, PNUD (Colombia)
Diana Díaz-Rodríguezix
Programa de Naciones Unidas para el Desarrollo, PNUD (Colombia)
Nathalie Leal Gómezx
Programa de Naciones Unidas para el Desarrollo, PNUD (Colombia)
Yanira Jiménez-Camposxi
Programa de Naciones Unidas para el Desarrollo, PNUD (Colombia)
Naturaleza y Sociedad. Desafíos Medioambientales • número 7 • septiembre-diciembre 2023 • pp.
https://doi.org/10.53010/nys7.02
Recibido: 30 de mayo de 2023 | Aceptado: 3 de noviembre de 2023
Resumen. La mayoría de los expertos que estudian las tendencias de las variaciones del clima coinciden en que los niveles de la temperatura y del CO2 registran un aumento atípico y sostenido en los últimos años. El efecto se sentirá en todos los sectores de la economía mundial, pero en los sistemas productivos de los pequeños agricultores, dada su alta vulnerabilidad, podría tener especial impacto. Considerando que la mayoría de los estudios en esta área se realizan midiendo el efecto individual de algunas variables, en el presente trabajo se evaluó el efecto simulado que causarían niveles elevados de temperatura (28, 30 y 32 °C) y de concentraciones de CO2 (380 y 420 μmol mol-1) sobre aspectos fotosintéticos importantes de algunas especies nativas de los pequeños productores de La Mojana, Colombia (punto de saturación de luz [PSL], punto de compensación de luz [PCL], tasa de fotosíntesis neta máxima [ANmax] y tasa de respiración en oscuridad [Ro]). Las especies se agruparon como hortalizas (ahuyama criolla, berenjena criolla y fríjol caupí), transitorias (arroz chombo, arroz bogotano y arroz LV) y perennes (café, roble y cacao). Los resultados más relevantes indicaron que tanto en concentraciones normales como altas de CO2, la temperatura afectaría las principales respuestas fotosintéticas de las especies. Las respuestas fotosintéticas de las especies hortícolas, a excepción de la ahuyama, se verían afectadas si la temperatura subiera a 30 y 32 °C en cualquiera de los dos escenarios simulados de CO2 ambiental. El comportamiento de las tres variedades de arroz fue diferencial, y el arroz bogotano y el arroz LV fueron relativamente tolerantes a temperaturas altas en condiciones normales o aumentadas de CO2, pero el arroz chombo sería más sensible a las altas temperaturas. En el grupo de las especies perennes, el café y el cacao fueron más sensibles y se afectarían principalmente ante temperaturas elevadas, en tanto que el roble no se vería afectado por las temperaturas con las concentraciones actuales de CO2 ambiental.
Palabras clave: cambio climático, curvas de respuesta a la luz, fotosíntesis máxima, La Mojana colombiana, pequeños productores
Gaseous Exchange of Native Agricultural Species in La Mojana Region in the Face of Increased Temperature and CO2
Abstract. Most experts who study climate variation trends agree that temperature and CO2 levels have shown an atypical and sustained increase in recent years. The effect will be felt in all sectors of the world economy, but the productive systems of small farmers, given their high vulnerability, could receive a higher impact. Considering that most studies in this area are carried out by measuring the individual effect of some variables, in the present work we evaluated the simulated effect caused by high temperature levels (28, 30, and 32 °C) and CO2 concentrations (380 and 420 μmol mol-1) on important photosynthetic aspects of some native species of small producers in La Mojana region in Colombia (light saturation point [LSP], light compensation point [LCP], maximum net photosynthetic rate [PNmax], and dark respiration rate [Rd]). The species were grouped as vegetables ([i] Cucurbita máxima, Duchense; [ii] Solanum melongena, L.; and [iii] Vigna unguiculata, L y Wald.), transients ([i] Oryza sativa, L. Cv: Chombo; [ii] Oryza sativa, L. Cv: Bogotano; and [iii] Oryza sativa, L. Cv: LV), and perennials ([i] Coffea arábica, L.; [ii] Tabebuia rosea, Bertol.; and [iii] Theobroma cacao, L.). The most relevant results indicated that at normal and high CO2 concentrations, temperature would affect the main photosynthetic responses of the species. The photosynthetic responses of the vegetable species, except for Cucurbita máxima, would be affected if the temperature rose to 30 and 32 °C in either of the two simulated scenarios of ambient CO2. The behavior of the three Oryza sativa varieties was differential; Bogotano rice and LV rice were relatively tolerant to high temperatures under normal or increased CO2 conditions, but Chombo rice would be more sensitive to high temperatures. In the group of perennial species, Coffea arábica and Theobroma cacao were more sensitive and would be affected mainly by high temperatures, whereas Tabebuia rosea would not be affected by temperatures at current ambient CO2 concentrations.
Keywords: climate change, Colombia, La Mojana region, light response curves, maximum photosynthesis, small farmers
Trocas gasosas de espécies agrícolas autóctones de La Mojana diante do aumento da temperatura e do CO2
Resumo. A maioria dos especialistas que estudam as tendências das variações climáticas concorda que a temperatura e os níveis de CO2 registaram um aumento atípico e contínuo nos últimos anos. O efeito será sentido em todos os setores da economia global, mas os sistemas agrícolas de pequenos agricultores, devido à sua alta vulnerabilidade, podem ser particularmente afetados. Considerando que a maioria dos estudos nessa área é realizada medindo o efeito individual de algumas variáveis, no presente trabalho, o efeito simulado de níveis elevados de temperatura (28, 30 e 32 °C) e concentrações de CO2 (380 e 420 μmol mol-1) em aspectos fotossintéticos importantes de algumas espécies nativas de pequenos agricultores em La Mojana, Colômbia (ponto de saturação de luz [PSL], ponto de compensação de luz [PCL], taxa fotossintética líquida máxima [ANmax] e taxa de respiração no escuro [Ro]). As espécies foram agrupadas como vegetais ([i] Cucurbita máxima, Duchense; [ii] Solanum melongena, L.; e [iii] Vigna unguiculata, L y Wald.), transientes ([i] Oryza sativa, L. Cv: Chombo; [ii] Oryza sativa, L. Cv: Bogotano; e [iii] Oryza sativa, L. Cv: LV) e perenes ([i] Coffea arábica, L.; [ii] Tabebuia rosea, Bertol.; e [iii] Theobroma cacao, L.). Os resultados mais relevantes indicaram que, tanto em concentrações normais como em concentrações elevadas de CO2, a temperatura afetaria as principais respostas fotossintéticas das espécies. As respostas fotossintéticas das espécies hortícolas, com exceção da Cucurbita máxima, seriam afetadas se a temperatura subisse para 30 e 32 °C em qualquer um dos dois cenários simulados de CO2 ambiental. O comportamento das três variedades de arroz foi diferenciado, sendo o arroz bogotano e o arroz LV relativamente tolerantes a temperaturas elevadas em condições normais ou de aumento de CO2, mas o arroz chombo seria mais sensível a temperaturas elevadas. No grupo das espécies perenes, o Coffea arábica e o Theobroma cacao foram mais sensíveis e seriam principalmente afetados por temperaturas elevadas, enquanto o Tabebuia rosea não seria afetado pelas temperaturas nas atuais concentrações de CO2 ambiental.
Palavras-chave: curvas de resposta à luz, fotossíntese máxima, La Mojana colombiana, mudança climática, pequenos agricultores
Introducción
Las variaciones climáticas hacen que los fenómenos meteorológicos extremos sean la “nueva normalidad”. Introduce varias capas de incertidumbre que afectan la forma en que los humanos se relacionan con la naturaleza (Fujimori et al., 2018). Así, la producción agrícola está muy influenciada por las condiciones climáticas, que han traído consecuencias por fenómenos naturales que el ser humano no puede controlar y que afectan la productividad agrícola en todas las regiones del mundo (Wang et al., 2022). El crecimiento demográfico para el año 2050 o 2100 llegaría a los 9 000 o 10 400 millones de personas en el mundo. Entre tanto, se tiene que ir pensando en estrategias de resiliencia frente a las variaciones climáticas que permitan garantizar la seguridad alimentaria (Kunimitsu y Nishimori, 2020).
Las variaciones climáticas extremas, como el aumento de la temperatura media global y el incremento progresivo de la concentración de CO2 en la atmósfera, son unos de los principales factores externos determinantes en el sector agrícola. Estos traerían como sinergia una disminución en la producción bajo eventos climáticos futuros debido al aumento de la población mundial (Sun et al., 2022). En ese sentido, existe cierta evidencia que permite prever la gravedad de los riesgos para la seguridad alimentaria y la nutrición derivados de las variaciones climáticas, que se espera que aumenten con más fuerza después del año 2050 y hacia 2080 (Kunimitsu y Nishimori, 2020). Consecuentemente, la gravedad del riesgo de las variaciones climáticas para la seguridad alimentaria está directamente relacionada con los niveles de la temperatura y de CO2, que afectará muchas especies de importancia agronómica, por lo que algunos recursos fitogenéticos se podrían extinguir (erosión genética) (Chiu et al., 2023).
Los efectos del aumento de la temperatura y de las concentraciones de CO2 son indicadores importantes para estudiar el impacto que estas podrían generar en la productividad de los cultivos (Kunimitsu y Nishimori, 2020). La interacción de estos factores externos sobre las plantas causa estrés, lo cual induce la producción de especies reactivas de oxígeno (ERO), que a su vez dañan las membranas celulares y desencadenan respuestas de estrés. Por consiguiente, las moléculas de ERO abarcan los radicales libres del metabolismo del oxígeno (O2), incluidos los radicales superóxido (O2-) e hidroxilo (OH-), el peróxido de hidrógeno (H2O2) y el oxígeno singlete (Zhou et al., 2019). De este modo, la acumulación de estas moléculas afecta los componentes celulares y provoca daños en las membranas a través de la peroxidación lipídica (Yalcinkaya et al., 2019). Además, podrían causar daños en el aparato fotosintético (fotosistema II y I), lo que impediría la excitación de las moléculas de clorofila a, necesarias para la cadena de transporte de electrones a través del estado oxido-reducción. Esto servirá para la producción de moléculas de energía (adenosín trifosfato, ATP) y poder reductor (nicotiamina adenina dinucleotido fosfato, NADPH), para ser usadas en el ciclo de Calvin-Benson para la fijación del dióxido de carbono (CO2) de la fotosíntesis y la síntesis de carbohidratos (Tiwari et al., 2017). Sin embargo, las plantas pueden adaptarse a la interacción de los factores externos por varios mecanismos, que incluyen la inducción de antioxidantes y procesos de señalización para superponer el daño de ERO, el uso de metabolitos, proteínas y lípidos de membrana para hacer frente al estrés por aumento de la temperatura y del CO2, desde un enfoque interactivo (Duc et al., 2018; Verma et al., 2015).
Dadas las consecuencias que traen los factores de las variaciones del clima en las plantas, los agricultores, en general, están expuestos a sus efectos adversos, que generan menores rendimientos y cambios en la calidad de los frutos. Las medidas de adaptación sugieren el uso de diferentes estrategias en las explotaciones y en los procesos de transferencia de riesgos, así como el ajuste a los efectos actuales y futuros de las variaciones del clima en la agricultura (Farley et al., 2011; Marić et al., 2023). Entre esas estrategias, se incluyen el uso eficiente del agua, las prácticas ecológicas, el aumento del almacenamiento de agua, el manejo sostenible de los suelos agrícolas y el uso de especies vegetales nativas que expresen una alta variabilidad genética en la resistencia de los factores externos ante las variaciones del clima ya mencionados (Dipierri y Zikos, 2020). La implementación de dichas estrategias parece ser un enfoque prometedor y sostenible en el contexto de los desafíos climáticos actuales (Karklelienė et al., 2023).
Los recursos fitogenéticos son la clave para adaptar los cultivos a un clima cambiante, y su importancia es clara, pero queda mucho por hacer. Por un lado, deben preservarse mediante diferentes métodos de conservación in situ y ex situ (Doi et al., 2020). Por otro lado, debe generarse información genotípica y fenotípica extensa para identificar atributos agronómicos de interés y estudiar el comportamiento de estas ante eventos futuros de variación climática en escenarios simulados (Karklelienė et al., 2023). Esto permitiría encontrar recursos fitogenéticos valiosos y resilientes a las variaciones climáticas extremas. Estos recursos son custodiados por los pequeños productores a través de la historia de la agricultura (Farley et al., 2011). Los materiales seleccionados y el uso de recursos genéticos de pequeños productores bien adaptados a las condiciones locales de La Mojana permitirían obtener recursos fitogenéticos de importancia para una agricultura climáticamente inteligente (AGI) y sostenible (Peña-Lévano et al., 2019).
Los recursos fitogenéticos de los pequeños productores de la región de La Mojana podrían presentar una mayor variabilidad genética y fenotípica que las especies domesticadas y, por lo tanto, brindarían un rico acervo genético que constituye una herramienta útil para los programas de producción de alimentos (Pathirana y Carimi, 2022). Además, es probable que este recurso amplíe la base genética de las variedades cultivadas mediante la introducción de genes deseables, necesarios para enfrentar los desafíos de la crisis alimentaria y la variación climática (Rajpal et al., 2023).
En ese contexto, el objetivo de este trabajo de investigación fue evaluar las respuestas fotosintéticas de algunos recursos fitogenéticos de pequeños productores y pueblos zenúes adaptados en la región de La Mojana sucreña (Colombia) en escenarios futuros simulados de las variaciones climáticas a través del aumento de la temperatura y la concentración de CO2 para determinar su capacidad de resiliencia ante estos eventos adversos.
Materiales y métodos
Área de estudio, material vegetal y condiciones de crecimiento
El experimento se realizó bajo condiciones de campo, durante el 2022, en la finca Los Laureles, ubicada en San Marcos, Sucre, Colombia (8° 42’ 34,6’’; 25 m s. n. m.). En la región, la precipitación media anual es de 4 493 mm, con una humedad relativa del 77 % en promedio y una temperatura media anual de 27,4 °C.
Para llevar a cabo el experimento, se emplearon semillas autóctonas nativas proporcionadas por pequeños productores y comunidades zenúes de la región (tabla 1). Las plantas se dispusieron en bolsas de polipropileno con una capacidad de 5 kg, que contenían sustrato compuesto por una mezcla de suelo con textura franco-arenosa y turba de coco en una proporción de 1:1. Respecto de las condiciones de crecimiento para el grupo de hortalizas, se mantuvo el crecimiento vegetativo de las plantas hasta alcanzar los 50, 60 y 35 días después de la germinación (DDG), previo al inicio de la fase reproductiva para ahuyama criolla, berenjena criolla y fríjol caupí, respectivamente. Mientras que, en el caso del grupo de arroces, las tres variedades se mantuvieron en plena fase exponencial de crecimiento hasta alcanzar el estado de máximo macollamiento, que precede a la fase de diferenciación de las estructuras reproductivas, y que se alcanzó aproximadamente a los 60 DDG. Por último, en el grupo de perennes, las especies se desarrollaron en condiciones de crecimiento vegetativo durante cuatro meses completos, es decir, 120 DDG. Este periodo permitió que las plantas desarrollaran un sistema de raíces sólido y una estructura vegetativa robusta. A partir de cada estado diferencial de crecimiento del grupo de especies, bajo condiciones semicontroladas en campo, las plantas se regaron y fertilizaron de acuerdo con el estado fenológico.
|
Grupo |
Especies |
|
|
Nombre vulgar |
Nombre científico |
|
|
Hortalizas |
Ahuyama criolla |
Cucurbita moschata Duchesne ex Poir, 1786. |
|
Berenjena criolla |
Solanum melongena L. |
|
|
Fríjol caupí |
Vigna unguiculta L (Walp). |
|
|
Transitorias |
Arroz chombo/p> |
Oryza sativa L., 1753 |
|
Arroz bogotano |
Oryza sativa L., 1753 |
|
|
Arroz LV |
Oryza sativa L., 1753 |
|
|
Perennes |
Café |
Coffea arabica L. |
|
Roble |
Quercus robur |
|
|
Cacao |
Theobroma cacao L., 1753 |
|
Tabla 1. Relación de especies hortícolas, transitorias y perennes sometidas a condiciones de aumento de concentración de CO2, temperatura e intensidades de luz en la cámara foliar del medidor de fotosíntesis en la región de La Mojana en 2021-22. Fuente: elaboración propia.
Diseño experimental y tratamientos
Con el propósito de determinar las respuestas fotosintéticas de las especies nativas, el experimentó se realizó bajo un diseño completo al azar con arreglo factorial de 3 × 2, donde el primer factor correspondió a los niveles de temperatura (28, 30 y 32 °C), y el segundo factor correspondió a las concentraciones de CO2 (380 y 420 μmol mol-1), para un total de 6 tratamientos. En cada combinación de estos factores, se midieron las tasas de fotosíntesis neta (AN) en cada uno de los 14 niveles de luz prefijado, que se describirán en el siguiente acápite, para la determinación de los parámetros fotosintéticos. El experimento para cada especie consistió en 6 tratamientos con 3 repeticiones, lo que resultó en un total de 18 unidades experimentales (UE). Cada UE estuvo compuesta por una planta, lo que generó una población de muestra de 18 plantas por especie.
Curvas de respuesta a la luz
Diversos estudios han demostrado que el momento ideal donde las plantas pueden expresar su potencial fotosintético en respuesta a la intensidad de la luz es entre las 9:00 a. m. y las 11:00 a. m. (Vitale et al., 2023). Para determinar el efecto de los tratamientos sobre la respuesta fotosintética de las plantas ante escenarios simulados de incremento de temperatura y concentración de CO2 en el ambiente, se seleccionó una hoja completamente expandida, sana y fotosintéticamente activa del tercio superior de las especies hortícolas, transitorias y perennes descritas en la tabla 1. Las variables respuesta se registraron con un sistema portátil de intercambio de gases (LI-6800, LI-COR Biosciences, Lincoln, NE, EE. UU.), después de alcanzar las condiciones de estado estacionario (al menos 5 minutos), tal como lo describe Wang et al. (2023). Para ello, la configuración de la cámara foliar se fijó con una humedad relativa del 70 % y una tasa de flujo de aire de 500 μmol s-1, así como tres niveles de temperatura (28, 30 y 32 °C) y dos concentraciones de referencia de CO2 (380 y 400 μmol mol-1), para estudiar la respuesta fotosintética de las plantas bajo 14 intensidades de luz, después de un pulso de saturación de 2 000 μmol m-2 s-1 en forma descendente (2 000, 1 600, 1 200, 900, 750, 600, 500, 400, 300, 200, 120, 60, 20 y 0 μmol m-2 s-1). A partir de la información, se construyó la curva de respuesta a la luz y se determinaron los siguientes parámetros: punto de saturación de luz (PSL), punto de compensación de luz (PCL), fotosíntesis neta máxima (ANmax) y tasa de respiración en oscuridad (Ro) (Pompelli et al., 2022).
Análisis estadístico de los datos
Se hizo una validación del análisis estadístico, en el que se evaluaron los supuestos de normalidad y homogeneidad de varianzas mediante el test de Shapiro-Wilk y el de Bartlett, respectivamente. Se utilizó análisis de varianza de una vía para examinar las diferencias significativas de las temperaturas y las concentraciones de CO2, mientras que la descomposición de la interacción se realizó con la prueba de contrastes ortogonales. Se empleó la prueba post hoc de Student-Newman-Keuls (SNK) (p < 0,05) usando programación SAS versión 9.4 (Statistical Analysis System, Inc., Cary, NC, EE. UU.). La construcción de las gráficas se llevó a cabo utilizando SigmaPlot, versión 14.0 (Systat Software) y las curvas de luz a la tendencia ajustada de los datos a un modelo hiperbólico no rectangular, teniendo en cuenta el coeficiente determinación (R2) y el p-valor.
Se utilizó un mapa de calor para las relaciones de las respuestas de la fotosíntesis neta máxima de las especies en condiciones normales (28 °C y 380 μmol mol de CO2), comparadas con los demás tratamientos de temperaturas y concentración elevada de CO2. Se utilizó el método de escala de color (entre -1 a 1). Las relaciones en escala de color se construyeron con Microsoft ® Office 360 (Microsoft Corporation, Redmond, WA, EE. UU.) y CorelDRAW Graphics Suite X8 (Corel Corporation, Ottawa, ON, Canadá).
Resultados
Grupo de especies hortícolas
Ahuyama criolla. En un ambiente normal de 380 μmol mol-1 de CO2 ambiental, las curvas de respuesta a la luz indicaron que, en esta especie, las mayores tasas de fotosíntesis se observan cuando la temperatura ambiente es de 28 °C (figura 1A), aunque estas tasas no difieren de las observadas al simular temperaturas de 30 y 32 °C. La mayor tasa de fotosíntesis neta (ANmax) se presentó significativamente a 30 °C con 32,31 μmol CO2 m-2 s-1, en comparación con 28 y 32 °C, respectivamente. En relación con el punto de saturación lumínica (PSL), se evidenciaron a temperaturas de 28, 30 y 32 °C valores de 1 960,02, 1 719,48 y 1 921,28 μmol fotones m-2 s-1, respectivamente (tabla 2). Esto sugeriría que esta especie podría adaptarse en zonas donde la radiación incidente no supere los 2 000 μmol fotones m-2 s-1 en ambientes normales de CO2.
Por otra parte, bajo un ambiente aumentado de CO2 con 420 μmol mol-1, la respuesta de las curvas de luz no reveló diferencias marcadas a las variaciones de temperatura (figura 1B). De ese modo, las curvas de respuesta a la luz explican que las plantas no mostraron diferencias significativas en su ANmax (30,56, 29,69 y 30,37 μmol CO2 m-2 s-1) cuando recibieron una intensidad de radiación límite de 1 905,52, 1 911,87 y 1 944,64 μmol fotones m-2 s-1, respectivamente (tabla 2). Esto sugeriría que las plantas podrían adaptarse a ambientes aumentados de CO2, independientemente de las variaciones de temperatura entre los 28 y 32 °C, y en zonas donde la radiación no supere los 2 000 μmol fotones m-2 s-1. En general, en ambientes aumentados de CO2, las plantas incrementaron sus máximas tasas de ANmax en un 10,01, y un 16,85 % a temperaturas de 28 y 32 °C respectivamente, comparadas con aquellas que estuvieron en ambientes normales de CO2. Esto permite suponer que las plantas de ahuyama criolla expresan su respuesta fotosintética cuando tienen una mayor disponibilidad de CO2 en el ambiente, con incrementos moderados de ANmax, de acuerdo con el comportamiento del metabolismo C3 de la especie.

Figura 1. Curvas de respuesta de la fotosíntesis neta de la hoja (AN) de la ahuyama criolla (A, B), berenjena criolla (C, D) y fríjol caupí (E, F), en función de tres niveles temperatura (28, 30 y 32 °C), bajo escenarios simulados a una concentración de 380 μmol mol-1 CO2 (A, C y E) y 420 μmol mol-1 CO2 (B, D y F). Los datos son medias ± desviación estándar (n = 3). Fuente: elaboración propia.
|
Especie |
Concentración CO2 (μmol mol-1) |
Temperatura (°C) |
ANmáx (μmol CO2 m-2 s-1) |
PCL (μmol fotones m-2 s-1) |
PSL (μmol fotones m-2 s-1) |
RO (μmol CO2 m-2 s-1) |
|
Ahuyama criolla |
380 |
28 |
27,78 b |
7,14 a |
1 960,02 a |
2,55 a |
|
30 |
32,31 a |
5,66 b |
1 719,48 c |
1,46 c |
||
|
32 |
25,99 b |
7,47 a |
1 921,28 b |
2,41 a |
||
|
420 |
28 |
30,56 a |
6,52 a |
1 905,52 b |
1,89 b |
|
|
30 |
29,69 a |
6,68 a |
1 911,87 b |
2,07 a |
||
|
32 |
30,37 a |
6,67 a |
1 944,64 a |
1,97 a |
||
|
Berenjena criolla |
380 |
28 |
22,56 a |
8,63 c |
1 994,76 a |
2,75 a |
|
30 |
13,32 b |
14,44 b |
1 999,46 a |
1,73 b |
||
|
32 |
11,37 c |
16,33 a |
1 990,77 a |
1,76 b |
||
|
420 |
28 |
13,16 a |
15,63 a |
1 993,07 a |
0,90 b |
|
|
30 |
13,24 a |
15,04 a |
1 997,73 a |
1,32 a |
||
|
32 |
12,58 a |
15,66 a |
1 992,75 a |
1,33 a |
||
|
Fríjol caupí |
380 |
28 |
28,63 a |
7,16 b |
1 996,02 a |
2,22 a |
|
30 |
11,27 b |
19,27 a |
1 981,65 a |
0,15 b |
||
|
32 |
13,08 b |
7,37 b |
1 044,18 b |
2,26 a |
||
|
420 |
28 |
30,16 a |
6,80 b |
1 995,46 a |
2,35 a |
|
|
30 |
17,35 b |
8,72 a |
1 522,52 b |
1,84 b |
||
|
32 |
15,15 c |
8,06 a |
1 269,69 c |
2,07 a |
Tabla 2. Parámetros fotosintéticos derivados de las curvas de respuesta a la luz, fotosíntesis neta máxima (ANmax, μmol CO2 m-2 s-1), punto de compensación de luz (PCL, μmol fotones m-2 s-1), punto de saturación lumínica (PSL, μmol fotones m-2 s-1) y respiración en oscuridad (RO, μmol CO2 m-2 s-1) en función de los niveles de temperatura (28, 30 y 32 °C), bajo dos escenarios simulados de CO2 (380 y 420 μmol mol-1) en el grupo de tres especies hortícolas cultivadas por pequeños productores de La Mojana. Nota: letras minúsculas diferentes en la misma columna indican diferencia significativa entre niveles de temperatura el escenario simulado de CO2 para cada especie según la prueba de comparación múltiple de Student-Newman-Keuls (SNK) (p < 0,05). Los valores denotan la media ± desviación estándar (n = 3). Fuente: elaboración propia.
Berenjena criolla. La figura 1C indica que las plantas de berenjena criolla bajo un ambiente normal simulado de CO2 (380 μmol mol-1) mostraron una reducción significativa de sus tasas de ANmax del 40,96 % (13,32 μmol CO2 m-2 s-1) y 49,60 % (11,37 μmol CO2 m-2 s-1) conforme aumentó la temperatura de 30 a 32 °C, comparados con aquellas que estuvieron a temperatura ambiente normal de 28 °C (ANmax = 22,56 μmol CO2 m-2 s-1). Por su parte, la tabla 2 muestra que los puntos de saturación de luz no difirieron significativamente con el aumento de la temperatura de 28, 30 y 32 °C (1 994,76, 1 999,46 y 1 990,77 μmol fotones m-2 s-1 respectivamente), lo que sugiere que, bajo condiciones normales de concentración del CO2 en la atmósfera, el factor principal que afectaría la ANmax de la berenjena criolla serían temperaturas superiores a 28 °C, independientemente del nivel de luz.
Por otro lado, en un ambiente simulado donde se incremente la concentración atmosférica de CO2 a 420 μmol mol-1, la respuesta de las tasas de ANmax y los PSL de la berenjena criolla no muestra diferencias significativas evidentes a las variaciones de temperatura (figura 1D). Esto podría suponer que la bioquímica fotosintética de esta especie no se vería seriamente afectada, bajo escenarios de alta concentración atmosférica de CO2 y altos niveles de radiación. Sin embargo, es importante resaltar que estas plantas sí redujeron sus tasas ANmax, si se comparan con aquellas que crecerían en un ambiente normal de CO2 (380 μmol mol-1) y temperatura (28 °C). La caída del 46,7 % de la ANmax de la berenjena criolla al pasar de un ambiente normal a uno aumentado de concentración de CO2, dentro de un mismo valor de temperatura constante de 28 °C, no coincide con lo esperado para una especie de metabolismo C3 (tabla 2), por lo que esta especie debería estudiarse con más detenimiento, considerando otras respuestas como la concentración interna de CO2, en la hoja, la conductancia estomática, la transpiración y el déficit de presión de vapor, entre otros.
Fríjol caupí. En esta especie se observó el mismo patrón de comportamiento de la ANmax en función de las concentraciones de CO2 (380 y 420 μmol mol-1), temperaturas (28, 30 y 32 °C) e intensidades de luz, con lo que se evidencia una reducción progresiva de las tasas ANmáx conforme aumentó la temperatura (figura 1E). En un ambiente normal de CO2, la disminución significativa de la ANmax, al pasar de 28 a 30 °C, fue de 60,64 % (11,27 μmol CO2 m-2 s-1), y de 54,31 % al pasar a 32 °C (13,08 μmol CO2 m-2 s-1), respecto con el testigo evaluado a 28 °C (ANmax = 28,63 μmol CO2 m-2 s-1). Asimismo, las respuestas fotosintéticas indican que, ante una eventual temperatura de 32 °C, esta especie se saturaría rápidamente a una radiación de 1 044,18 μmol fotones m-2 s-1, lo que sugeriría un efecto negativo de las altas temperaturas en la eficiencia fotosintética (tabla 2).
Desde una visión generalizada y bajo un escenario hipotético, los resultados del presente trabajo mostraron que, cuando la concentración ambiental de CO2 se aumentó a 420 μmol mol-1, las tasas de ANmax de fríjol caupí se incrementaron respecto a un ambiente de concentración normal de este gas (figura 1F). Estos aumentos fueron del orden del 5,07 % (30,16 μmol CO2 m-2 s-1 vs. 28,63 μmol CO2 m-2 s-1) a 28 °C, de 35,04 % (17,35 μmol CO2 m-2 s-1 vs. 11,27 μmol CO2 m-2 s-1) a 30 °C, y de 13,66 % (15,14 μmol CO2 m-2 s-1 vs. 13,08 μmol CO2 m-2 s-1) a 32 °C. En efecto, los resultados permiten apreciar que las tasas ANmax disminuyeron progresivamente por el aumento de la temperatura y se saturaron más rápidamente en la medida que este parámetro se aumentó de 28 a 30 y 32 °C (1 995,46, 1 522,52 y 1 269,60 μmol fotones m-2 s-1 respectivamente), lo cual confirma el efecto de las altas temperaturas sobre la respuesta fotosintética (tabla 2). De manera general, podría inferirse que las plantas de fríjol caupí se verían afectadas negativamente por el aumento de la temperatura, pero positivamente por el incremento del CO2 ambiental, lo que evidentemente no se daría en condiciones naturales, ya que los aumentos sostenidos de CO2 conducen generalmente a aumentos de la temperatura ambiental.
Al considerar el punto de compensación de luz (PCL, donde la tasa fotosintética iguala la producción de CO2 por procesos respiratorios) y el balance neto de carbono (BNC, comparación de la ANmax vs. la respiración en oscuridad RO, es decir, el gasto de carbono usado para el mantenimiento de la planta, cuando la temperatura pase de 28 a 32 °C), en el grupo de las especies hortícolas, se pudieron evidenciar diferencias marcadas.
En la ahuyama criolla, el PCL se mantuvo al variar la temperatura, independientemente del nivel de CO2. El BNC indicó que, a 380 μmol mol CO2, las tasas de ANmax y laRo se reducen en un 6,44 y 5,49 % respectivamente, lo que sugiere que la respuesta de la planta es de ganancia neta de carbono; a 420 μmol de CO2, las tasas de ANmax se mantuvieron con un incremento del 9,32 % y la Ro disminuyó significativamente en un 22,75 %, lo que indicaría que la planta perdería carbono por respiración si la temperatura aumentase estos 4 °C, aunque esta podría encontrarse en un estado de mantenimiento.
En el caso de la berenjena criolla, bajo condiciones normales de CO2, el PCL se duplicó significativamente al aumentar la temperatura. Sin embargo, cuando incrementó el CO2, el PCL no relevó diferencias significativas. En esta especie, el BNC indicó que, tanto a concentraciones normales como aumentadas de CO2, los incrementos que tendrían las tasas de ANmax vs. la Ro, implicarían pérdidas netas de C, principalmente en una atmósfera saturada de CO2, donde la ANmax decrecería en un 44,24 % y la Ro se incrementaría críticamente en un 51,64 %. Para el fríjol caupí, el PCL se mantuvo cuando se incrementó el CO2 y la temperatura. En condiciones normales y aumentadas de CO2, las tasas de ANmax no superarían las pérdidas de la Ro; en la primera condición de CO2, la ANmax sería de -54,31 % y las Ro de 1,8 %, por lo que la planta estaría en un estado crítico; a 420 μmol mol de CO2, las tasas de ANmax disminuiría en 47,08 % y la Ro en 6,76 %, mostrando el mismo patrón crítico (figura 2).

Figura 2. Mapa de calor que muestra el impacto del cambio climático global en la fotosíntesis neta (AN) (fotosíntesis bruta - respiración oscura) de especies del grupo de las hortalizas. Los valores cálidos denotan una disminución de la AN,mientras que los valores fríos denotan un aumento de la AN. Para estandarizar los tratamientos se hizo una razón entre el tratamiento y el control (28 °C, 380 μmol mol-1 CO2). Fuente: elaboración propia.
Grupo de especies transitorias
Arroz chombo. Las curvas de respuesta a la luz del arroz chombo indicaron un comportamiento diferencial en función de la temperatura y la concentración de CO2. La figura 3A muestra que, cuando esta especie se encuentra bajo una atmósfera de CO2 de 380 μmol mol-1, la temperatura demostró ser determinante sobre las tasas de ANmax, generando una reducción significativa del 46,59 % (14,79 μmol CO2 m-2 s-1) y 44,78 % (15,29 μmol CO2 m-2 s-1) si las temperaturas son de 30 y 32 °C, respectivamente, comparados con condiciones normales de temperatura de 28 °C (27,69 μmol CO2 m-2 s-1). Otro aspecto importante es que, independientemente de la temperatura, las plantas se saturarían con valores de radiación alrededor de 2 000 μmol fotones m-2 s-1 (tabla 3); por encima de ese nivel de luz, el daño podría ser perjudicial debido el estrés térmico del efecto interactivo de la temperatura y la intensidad de luz sobre la actividad fotosintética de esta especie.
En un ambiente de 420 μmol mol-1 de CO2, el efecto directo de la temperatura causó que las plantas redujeran significativamente sus tasas ANmax de 19,99 a 13,06 μmol CO2 m-2 s-1 al pasar de 28 a 32 °C. Así mismo, este aumento de la temperatura ocasionó que las plantas redujeran significativamente su PSL de 1 987,89 a 1 475,27 μmol fotones m-2 s-1, sugiriendo que estas altas temperaturas podrían ocasionar reducciones en la eficiencia fotosintética (figura 3B). Desde un punto comparativo de los dos ambientes contrastantes de CO2 (380 μmol mol-1 vs. 420 μmol mol-1), se pudo establecer que este aumento causó una disminución de las tasas de AN de manera sorprendente para una especie de metabolismo C3. En ese sentido, esta especie tendría problemas por efectos del aumento de la temperatura y la concentración de CO2 ambiental, siendo crítico en escenarios de 32 °C y 420 μmol mol-1 de CO2 (tabla 3).

Figura 3. Curvas de respuesta de la fotosíntesis neta de la hoja (AN) del arroz chombo (A y B), arroz bogotano (C y D) y arroz LV (E y F), en función de tres niveles temperatura (28, 30 y 32 °C), bajo escenarios simulados a una concentración de 380 μmol mol-1 CO2 (A, C y E) y 420 μmol mol-1 CO2 (B, D y F). Los datos son medias ± desviación estándar (n = 3). Fuente: elaboración propia.
|
Especie |
Concentración CO2 (μmol mol-1) |
Temperatura (°C) |
ANmáx (μmol CO2 m-2 s-1) |
PCL (μmol fotones m-2 s-1) |
PSL (μmol fotones m-2 s-1) |
RO (μmol CO2 m-2 s-1) |
|
Arroz chombo |
380 |
28 |
27,69 a |
7,42 c |
1 977,12 a |
1,83 b |
|
30 |
14,79 c |
13,66 a |
1 988,29 a |
1,22 c |
||
|
32 |
15,29 b |
11,89 b |
1 905,01 b |
2,11 a |
||
|
420 |
28 |
19,99 a |
10,01 a |
1 987,89 b |
1,87 a |
|
|
30 |
19,21 a |
10,40 a |
1 994,61 a |
1,87 a |
||
|
32 |
13,06 b |
10,87 a |
1 475,27 c |
1,72 a |
||
|
Arroz bogotano |
380 |
28 |
20,62 b |
13,77 b |
1 373,82 a |
3,84 a |
|
30 |
20,54 b |
19,96 a |
1 100,19 b |
3,83 a |
||
|
32 |
22,74 a |
9,95 c |
1 076,94 c |
3,09 c |
||
|
420 |
28 |
25,82 a |
23,11 c |
1 600,75 a |
3,50 a |
|
|
30 |
20,77 b |
43,84 a |
1 411,88 b |
3,56 a |
||
|
32 |
17,77 c |
28,73 b |
1 382,07 c |
3,56 a |
||
|
Arroz LV |
380 |
28 |
8,91 c |
6,02 c |
588,15 c |
1,68 b |
|
30 |
11,27 b |
11,09 b |
1 367,34 b |
1,97 a |
||
|
32 |
14,87 a |
13,54 a |
1 995,15 a |
1,32 c |
||
|
420 |
28 |
20,63 a |
9,78 b |
1 999,99 a |
1,88 a |
|
|
30 |
15,46 b |
13,01a |
1 991,30 a |
1,36 c |
||
|
32 |
13,89 c |
13,28 a |
1 880,31 b |
1,63 b |
Tabla 3. Parámetros fotosintéticos derivados de las curvas de respuesta a la luz, fotosíntesis neta máxima (ANmax, μmol CO2 m-2 s-1), punto de compensación de luz (PCL, μmol fotones m-2 s-1), punto de saturación lumínica (PSL, μmol fotones m-2 s-1) y respiración en oscuridad (RO, μmol CO2 m-2 s-1) en función de los niveles de temperatura (28, 30 y 32 °C), bajo dos escenarios simulados de CO2 (380 y 420 μmol mol-1) en el grupo de tres genotipos de arroz cultivadas por pequeños productores de La Mojana. Nota: las letras minúsculas diferentes en la misma columna indican diferencia significativa entre niveles de temperatura en cada escenario simulado de CO2 para cada especie según la prueba de comparación múltiple de Student-Newman-Keuls (SNK) (p < 0,05). Los valores denotan la media ± desviación estándar (n = 3). Fuente: elaboración propia.
Arroz bogotano. Las tendencias de las curvas de respuesta de la fotosíntesis de arroz bogotano ante los incrementos en los niveles de radiación fueron crecientes en ambos niveles de CO2, pero el comportamiento respecto a las temperaturas fue diferencial. En esta especie, bajo un efecto de concentración ambiental normal de CO2 (380 μmol mol-1), la ANmax sería significativamente mayor cuando las plantas están a temperaturas altas de alrededor de 32 °C (figura 3C), lo cual sugiere que, en las actuales circunstancias de la región, el arroz bogotano no se afectaría ante dichas temperaturas. Sin embargo, y de manera sorprendente, bajo condiciones aumentadas de CO2, las tasas de ANmax de un arroz bogotano que se cultiva a una temperatura ambiente de 28 °C, son significativamente superiores en un 20 y 31 % respecto a las observadas a temperaturas más altas como los 30 y 32 °C, respectivamente (tabla 3). Por su parte, en estas mismas condiciones de CO2 aumentado y temperatura ambiental normal, las plantas resistirían un poco más la radiación (figura 3D) al mostrar un punto de saturación de luz amplio (1 600,75 μmol fotones m-2 s-1) comparados con un ambiente normal de CO2 (1 373,82 μmol fotones m-2 s-1) a la misma temperatura de 28 °C (tabla 3). Además, las plantas que estén sometidas a una concentración de 380 μmol mol-1 de CO2, conforme aumenten la temperatura y las intensidades de luz. Así mismo, incrementarían sus tasas de ANmax, pero tendrían una saturación sensible a luz. Los resultados indican que, en términos generales, el arroz bogotano podría desarrollarse adecuadamente en zonas donde la radiación incidente no sobrepase aproximadamente de 1 200 μmol de fotones m-2 s-1, en concentraciones ambientales normales de CO2, y de 1 500 μmol de fotones m-2 s-1 en futuros escenarios con concentraciones de CO2 aumentado.
Arroz LV. En condiciones normales de CO2 ambiental (380 μmol mol-1), las variaciones de la temperatura influyeron en las tasas de ANmax de la variedad de arroz LV (figura 3E), las cuales tienden a ser significativamente mayores en la medida que esta variable ambiental se incrementa, registrando valores porcentuales respecto al testigo (28 °C), de 26,49 % a 30 °C y de 66,89 % a 32 °C. Así mismo, los puntos de saturación lumínica fueron significativamente mayores cuando la temperatura aumentó, registrando valores de 1 367,34 y 1 995,15 μmol fotones m-2 s-1 a los 30 y 32 °C respectivamente, comparados con los observados a condiciones normales de temperatura de 28 °C (588,15 μmol fotones m-2 s-1) (tabla 3). Esto permitiría suponer que el aumento de la temperatura hasta 32 °C no afectaría la actividad fotosintética de esta variedad, siempre y cuando la concentración de CO2 registre valores relativamente normales a los observados en la región (380 μmol mol-1).
Por otra parte, cuando se incrementó la concentración de CO2 ambiental a 420 μmol mol-1, los resultados indicaron que las plantas de arroz LV trabajarían fotosintéticamente mejor a 28 °C que a 30 y 32 °C (figura 3F), y que tendrían la potencialidad de resistir PSL más elevados que los observados a 380 μmol mol-1, independientemente de las temperaturas estudiadas a esta concentración de CO2. Los incrementos en los PSL de las plantas sometidas a atmósferas aumentadas de CO2, respecto a las que se evaluaron a condiciones normales de presión de este gas, fueron del 240 % (1 999,99 μmol fotones m-2 s-1) a 28 °C, 45,63 % (1 991,30 μmol fotones m-2 s-1) a 30 °C y 5,30 % (1 889,31 μmol fotones m-2 s-1) a 32 °C (tabla 3). Estos resultados permitirían suponer que esta variedad tendría la capacidad y eficiencia fotosintética de adaptarse a condiciones moderadas y relativamente altas de temperatura, alta concentración de CO2 atmosférico y una radiación incidente aproximada de hasta 2 000 μmol fotones m-2 s-1.
En el arroz chombo, el PCL se mantuvo relativamente estable cuando se incrementó el CO2 y la temperatura (tabla 3). Al considerar el BNC, bajo condiciones normales de CO2 y cuando la temperatura pasa de 28 a 32 °C, las tasas de ANmax cayeron significativamente en un 44,78 %, en tanto que la Ro se incrementó en un significativo 15,30 %, lo cual indica que la planta estaría en un estado crítico, debido a que la ganancia neta de carbono se redujo casi a la mitad de su máxima eficiencia, y la respiración aumentó. Aunque a 420 μmol mol-1 de CO2, las tasas de ANmax disminuyen en un 52,83 % y la Ro en un 6,01 %, constatado con el testigo, el balance seguiría siendo negativo (figura 4). Por otro lado, tanto para el arroz bogotano como el LV, el PCL no mostró un comportamiento consistente en función de la concentración de CO2 y la temperatura. El BNC indicó que, en el arroz bogotano, cultivado a 380 μmol mol-1 de CO2, las tasas de ANmax se incrementan en un 10,28 % y la Ro cae en un 19,53 % al aumentar la temperatura a 32 °C, esto permite evidenciar un estado de ganancia de C para la planta. Asimismo, cuando se incrementó el CO2 atmosférico, las tasas de ANmax disminuyeron en un 13,82 % y la Ro en un 7,29 %, aunque en este caso las ganancias de C no serían tan importantes como en el primer caso (figura 4). Finalmente, para el arroz LV, en condiciones normales de CO2 (380 μmol mol-1), las tasas de ANmax se incrementarían significativamente en un 66,89 % y la Ro disminuiría en un 21,43 %, mostrando que la ganancia de carbono neto por fotosíntesis es superior a las pérdidas por respiración, por lo que en estas condiciones la eficiencia fotosintética y adaptativa es deseable en esta especie. En la atmósfera saturada con 420 μmol mol-1 de CO2, el incremento de las tasas de ANmax fueron del 131,53 % y la Ro disminuyó ligeramente en un 2,98 % lo que sugiere el mismo patrón en la ganancia neta de carbono por encima de las pérdidas por respiración. Esto denota una alta eficiencia fisiológica, adaptativa y tolerante de esta especie en escenarios de aumento de la temperatura a 32 °C (figura 4).

Figura 4. Mapa de calor que muestra el impacto del cambio climático global en la fotosíntesis neta (AN) (fotosíntesis bruta - respiración oscura) de especies del grupo transitorias. Los valores cálidos denotan una disminución de la AN mientras que los valores fríos denotan un aumento de la AN. Para estandarizar los tratamientos se hizo una razón entre el tratamiento y el control (28 °C, 380 μmol mol-1 CO2). Fuente: elaboración propia.
Grupo de especies perennes
Café. En escenarios normales de un ambiente de CO2 con 380 μmol mol-1, se observó que la temperatura tuvo una influencia negativa en las tasas de AN de las plantas de café, y esta tendencia fue constante en la medida que se incrementaba la intensidad de luz; así, respecto al testigo (28 °C), las plantas redujeron significativamente las tasas de ANmax en un 65,95 % (3,49 μmol CO2 m-2 s-1) cuando la temperatura aumentó a 30 °C y en un 66,14 % (3,47 μmol CO2 m-2 s-1) cuando fue de 32 °C (figura 5A). Un aspecto interesante del café es que, en el caso de un posible aumento de temperatura a 32 °C, la especie podría presentar un PSL de un poco más del doble que el observado a 28 y 30 °C (1 996,90 μmol fotones m-2 s-1). Sin embargo, sus tasas de ANmax serían tan bajas que su eficiencia fotosintética estaría en riesgo (tabla 4), lo que confirma que el café presenta una mejor adaptación a niveles relativamente bajos de temperatura y radiación.
Al valorarse el efecto de concentraciones elevadas de CO2, las plantas mostraron una caída importante de la AN, respecto a la observada en las plantas que se evaluaron a 380 μmol mol-1 y 28 °C; además, revelaron un comportamiento similar de este parámetro en las tres temperaturas en función de la radiación incidente (figura 5B). Por su parte, la respuesta de los PSL se mostró errática bajo esta concentración de CO2, ya que los resultados sugieren que la especie se saturaría a una radiación significativamente mayor cuando se encuentra a una temperatura de 30 °C respecto a una de 32 °C (tabla 4). En términos generales, se pudo evidenciar que la especie muestra una sensibilidad negativa al aumento del CO2 y la temperatura.

Figura 5. Curvas de respuesta de la fotosíntesis neta de la hoja (AN) del café (A y B), roble (C y D) y cacao (E y F), en función de tres niveles temperatura (28, 30 y 32 °C), bajo escenarios simulados a una concentración de 380 μmol mol-1 CO2 (A, C y E) y 420 μmol mol-1 CO2 (B, D y F). Los datos son medias ± desviación estándar (n = 3). Fuente: elaboración propia.
|
Especie |
Concentración CO2 (μmol mol-1) |
Temperatura (°C) |
ANmáx (μmol CO2 m-2 s-1) |
PCL (μmol fotones m-2 s-1) |
PSL (μmol fotones m-2 s-1) |
RO (μmol CO2 m-2 s-1) |
|
Café |
380 |
28 |
10,25 a |
9,15 c |
918,19 b |
0,83 a |
|
30 |
3,49 b |
25,26 b |
904,84 c |
0,41 c |
||
|
32 |
3,47 b |
53,46 a |
1 996,90 a |
0,53 b |
||
|
420 |
28 |
3,46 a |
18,90 c |
692,98 c |
0,49 a |
|
|
30 |
2,64 c |
49,95 a |
1 362,11 a |
0,31 b |
||
|
32 |
3,03 b |
28,04 b |
894,31 b |
0,41 a |
||
|
Roble |
380 |
28 |
16,92 a |
12,63 a |
1 994,17 a |
0,58 c |
|
30 |
17,09 a |
11,76 b |
1 998,72 a |
1,59 a |
||
|
32 |
16,08 b |
12,92 a |
1 999,05 a |
1,02 b |
||
|
420 |
28 |
15,49 a |
13,53 b |
1 999,70 a |
0,85 c |
|
|
30 |
6,51 c |
14,32 a |
1 087,47 c |
1,44 a |
||
|
32 |
13,56 b |
12,62 c |
1 695,15 b |
1,21 b |
||
|
Cacao |
380 |
28 |
6,12 a |
8,43 c |
513,78 c |
0,59 a |
|
30 |
4,44 c |
27,64 a |
1 215,99 a |
0,39 c |
||
|
32 |
5,74 b |
21,12 b |
1 212,59 a |
0,55 a |
||
|
420 |
28 |
6,48 a |
23,85 c |
1 463,55 b |
0,30 b |
|
|
30 |
6,99 a |
25,11 b |
1 665,96 a |
0,34 b |
||
|
32 |
3,03 b |
28,04 a |
894,31 c |
0,41 a |
Tabla 4. Parámetros fotosintéticos derivados de las curvas de respuesta a la luz, fotosíntesis neta máxima (ANmax, μmol CO2 m-2 s-1), punto de compensación de luz (PCL, μmol fotones m-2 s-1), punto de saturación lumínica (PSL, μmol fotones m-2 s-1) y respiración en oscuridad (Ro, μmol CO2 m-2 s-1) en función de los niveles de temperatura (28, 30 y 32 °C), bajo dos escenarios simulados de CO2 (380 y 420 μmol mol-1) en el grupo de tres especies perennes cultivadas por pequeños productores de La Mojana. Nota: letras minúsculas diferentes en la misma columna indican diferencia significativa entre niveles de temperatura en cada escenario simulado de CO2 para cada especie según la prueba de comparación múltiple de Student-Newman-Keuls (SNK) (p < 0,05). Los valores denotan la media ± desviación estándar (n = 3). Fuente: elaboración propia.
Roble. Para un escenario de 380 μmol mol de CO2, las tasas de fotosíntesis de las plantas de roble presentaron el mismo patrón de la respuesta a la luz, en las tres temperaturas estudiadas; las tasas de ANmax y los PSL no difirieron significativamente entre sí al variar las temperaturas de 28 a 30 °C (figura 5C). Esto sugeriría que las plantas de roble presentarían una potencialidad fotosintética para adaptarse a aumentos de temperatura e intensidad de luz, dentro de los rangos estudiados. Sin embargo, ante una concentración atmosférica de CO2 de 420 μmol mol-1 (figura 5D), sorprendentemente se observaron valores significativamente más bajos de ANmax y PSL cuando las plantas se sometieron a 30 °C, sugiriendo que aún debe estudiarse con más detenimiento el comportamiento de esta especie bajo atmósferas aumentadas de CO2 (tabla 4). Ante estos resultados, es posible inferir que el roble sería una especie que podría adaptarse a aumentos moderados de temperatura y soportar altas intensidades de luz en condiciones normales de CO2, pero un incremento de este último podría generar una sensibilidad en su eficiencia fotosintética y adaptabilidad.
Cacao. En esta especie, bajo condiciones normales de CO2 ambiental (380 μmol mol-1), las variaciones de la temperatura influyeron en las tasas de AN en las plantas (figura 5E). La disminución significativa de la ANmax al pasar de 28 °C (testigo) a 30 y 32 °C fue del 27,45 % (4,44 μmol CO2 m-2 s-1) y 6,21 % (5,74 μmol CO2 m-2 s-1) respectivamente, en tanto que los PSL aumentaron significativamente al pasar de 514 μmol fotones m-2 s-1 en el testigo, a 1 216 y 1 213 μmol fotones m-2 s-1, en las plantas que se evaluaron a 30 y 32 °C respectivamente (tabla 4). Lo anterior sugeriría que, bajo condiciones normales de concentración atmosférica del CO2, estas plantas tendrían relativa capacidad fotosintética para resistir puntos de saturación lumínica mayores, conforme aumente la temperatura hasta los límites estudiados. En el otro escenario de concentraciones elevadas de CO2 (420 μmol mol-1), las respuestas de la fotosíntesis fueron similares al variar la temperatura y la radiación (figura 5F). Sin embargo, en este caso, temperaturas de 32 °C reducirían significativamente las tasas de ANmax en un 53 % y del PSL en un 39 % en cacao, respecto a los valores observados cuando las plantas se sometieron a una temperatura de 28 °C. Estos resultados sugieren que en zonas donde la temperatura promedio pueda alcanzar los 32 °C y que se superen niveles radiación incidente de aproximadamente 900 μmol de fotones m-2 s-1, el cacao podría tener problemas de adaptabilidad fotosintética en estos escenarios de variación climática por aumento de la temperatura y la concentración de CO2.
En las especies perennes, el punto de compensación de luz (PCL) y el BNC presentaron un comportamiento diferencial entre especies (tabla 4). En café, el PCL se aumentó significativamente cuando se incrementó el CO2 y la temperatura. En esta especie, cuando la temperatura pasó de 28 a 32 °C y bajo condiciones normales de CO2, las tasas de ANmax cayeron en un 66,14 % y la Ro en un 36,14 %; asimismo, a 420 μmol mol-1 de CO2, las tasas de ANmax disminuyeron en un 70,44 % y la Ro en un 50,60 %; en ambos casos, la planta estaría en un estado muy crítico, debido a que la ganancia neta de carbono se redujo significativamente más de la mitad de su máxima eficiencia y las pérdidas de carbono por respiración no cayeron tanto, lo que indica que la especie sería sensible al aumento del CO2 atmosférico y la temperatura (figura 6). Para el roble, el PCL se mantuvo en función de la concentración de CO2 y la temperatura. En esta especie, el aumento de temperatura en un ambiente de 380 μmol mol-1 de CO2, las tasas de ANmax fueron estables, pero la Ro incrementó en un 75,86 %, lo cual denota deficiencias en el BNC. Una situación más crítica ocurre a 420 μmol mol-1 de CO2, pues las tasas de ANmax disminuyeron en un 19,86 % y la Ro aumentó en un 108,62 %, con lo que se evidencia una afectación crítica en la ganancia neta de carbono (figura 6). En cacao, los valores del PCL se mantuvieron relativamente estables conforme aumentó la concentración de CO2 y la temperatura. Desde el punto de vista del BNC para esta especie, los resultados indicaron que, si aumenta la temperatura ambiente de 28 a 32 °C, bajo condiciones normales de CO2 (380 μmol mol-1), las tasas de ANmax se reducen ligeramente en un 6,21 % y la Ro disminuye en un 6,78 %, lo que muestra poco o moderado daño en la eficiencia fotosintética de la planta. Así mismo, bajo concentraciones ambientales de 420 μmol mol-1 de CO2, la disminución de las tasas de ANmax fueron del 50,49 % y la Ro de 30,50 %, lo que sugiere que, al aumentar la temperatura a 32 °C, las bajas tasas en la ganancia neta de C (AN) y las altas pérdidas de este elemento por el proceso respiratorio afectarían determinantemente la actividad fotosintética de la especie (figura 6).
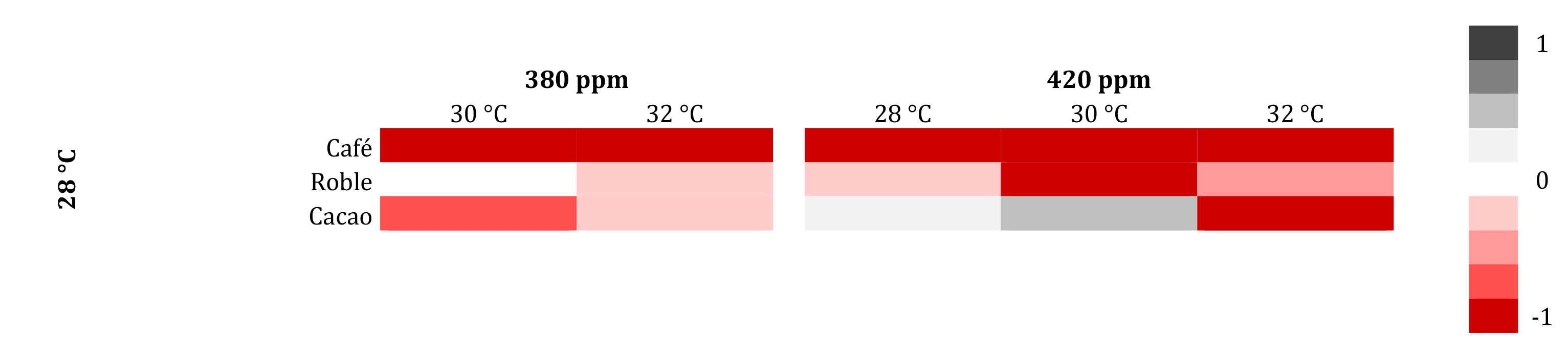
Figura 6. Mapa de calor que muestra el impacto del cambio climático global en la fotosíntesis neta (AN) (fotosíntesis bruta - respiración oscura) de especies del grupo perennes. Los valores cálidos denotan una disminución de la AN; mientras que los valores fríos, un aumento de la AN. Para estandarizar los tratamientos se hizo una razón entre el tratamiento y el control (28 °C, 380 μmol mol-1 CO2). Fuente: elaboración propia.
Discusión
La variabilidad climática y la adaptabilidad de las especies vegetales de importancia agronómica se enfrentarán a problemas apremiantes y riesgos inminentes en cuanto a seguridad alimentaria, debido a la demanda de producción de alimentos en relación con el aumento de la población en el mundo (Prieto-Benítez et al., 2023). Por tanto, unos de los aspectos inmersos en el estudio del comportamiento fisiológico de las plantas en escenarios simulados de variabilidad climática es entender los mecanismos de respuesta de la eficiencia fotosintética en función de la variación de algunos aspectos como la concentración de CO2 atmosférico, la temperatura y la radiación.
En primer lugar, el aumento de la concentración de CO2 en la atmósfera podría conducir a mayores tasas de AN, como se presentó en ahuyama criolla, arroz LV, roble y cacao (figuras 1, 3 y 5), así que estas tasas dependen en gran medida de la interacción de la temperatura y la radiación. Esto significa que las alteraciones causadas por el aumento del CO2 estudiado está fundamentado en las propiedades cinéticas de la enzima ribulosa-1,5-bisfosfato carboxilasa-oxigenasa (Rubisco) y de la regeneración de la ribulosa-1,5-bisfosfato (RuBP), ya que tendrían disponibles cantidades de CO2 para ser fijado eficientemente y responderían a altas tasas de AN en condiciones climáticas futuras (Kumari et al., 2022). Estudios han demostrado que el aumento del CO2 estimuló la fotosíntesis, que correlacionó positivamente en los componentes de rendimiento del trigo a bajas temperaturas, pero el efecto combinado del CO2 y la temperatura alivió el impacto negativo de las temperaturas altas, como un efecto mitigador del CO2 frente a la temperatura en esta especie (Ainsworth y Rogers, 2007; Yang et al., 2023). Por tanto, los efectos de la dinámica de la fotosíntesis también están condicionados por el aumento de la temperatura y la radiación.
El aumento de la temperatura genera una mayor disipación de la energía en forma de calor en el proceso de fotosíntesis, así que la energía aprovechada para fotoquímica es incipiente debido al estrés térmico en el aparato fotosintético, que comprende antenas colectoras de luz, centro de reacción y absorción de la luz por los pigmentos fotosintéticos (Snider et al., 2022; Tan et al., 2023). Eso explicaría que el estrés por temperatura provoca cambios fenotípicos, fisiológicos y bioquímicos en las plantas, pero el efecto negativo y reductor en las tasas AN son notorias, como se presentó en la ahuyama criolla, berenjena criolla, fríjol caupí, arroz chombo, arroz LV, roble y cacao. Asimismo, un aumento de la temperatura incrementa la velocidad de difusión de las moléculas de agua y promueve la transpiración. Esa pérdida de agua restringe la eficiencia de las tasas de AN en las plantas (Li et al., 2023). Las tasas de AN por efecto del aumento de la temperatura están sincronizadas con la reducción de la eficiencia fotoquímica (eP), la limitación de CO2 y el favorecimiento de la fotoinhibición, lo que afecta el rendimiento cuántico del fotosistema II (ΦPSII) al interrumpir los mecanismos fotosintéticos de las plantas y aumentar las tasas de fotorrespiración (Drake et al., 2018; Mathur et al., 2014; Von-Caemmerer y Evans, 2015). Es probable que la razón para que ciertas especies presentaran cierto grado de tolerancia a las altas temperaturas evaluadas recaiga en estrategias para reducir los efectos adversos, como el enfriamiento del aire por encima del dosel a través de la evaporación (Urban et al., 2017).
Las altas radiaciones afectan la captura de luz, el transporte de electrones del cloroplasto, las enzimas del ciclo de Calvin y los mecanismos de transporte de azúcar; favorece a su vez el aumento de la fotorrespiración, la pérdida de pigmentos fotosintéticos, la saturación de los complejos proteicos (PSII y PSI) y la reducción de las tasas de AN (He y Matthews, 2023). Algunas plantas pueden presentar saturación lumínica a bajas intensidades de luz, debido a que la cantidad de energía lumínica recibida daña el aparato fotosintético. En ese sentido, la degradación de algunas proteínas, como la Rubisco, por el incremento de la radiación incidente, aumentaría las temperaturas en la hoja, limitaría su especificidad por el CO2 y tendría un efecto negativo en la AN a intensidades de luz saturadas (Sánchez-Reinoso et al., 2019). Finalmente, la determinación principal de las tasas de AN con enfoque sobre escenarios de la variación climática, es fundamental para evaluar el potencial de los recursos fitogenéticos nativos de los pequeños productores y pueblos zenúes en la región de La Mojana, desde los aspectos adaptativos y fotosintéticos, en los que se podrían encontrar algunos que puedan presentar atributos agronómicos esenciales y variabilidad genética (Vishwakarma et al., 2023). Por tal razón, el uso de escenarios simulados a través de un equipo como el medidor portátil de intercambio de gases puede, por un lado, ayudar en la comprensión de las sensibilidades generales y de las respuestas fotosintéticas de los genotipos nativos, respecto a su comportamiento frente a unas condiciones climáticas cambiantes y, por el otro, proporcionar información valiosa para identificar nuevas estrategias y mejoras fotosintéticas de los recursos ante estas condiciones de estrés (Baath et al., 2021; Galmes et al., 2015).
Conclusiones
Los principales resultados indicaron que la ahuyama criolla podría ser una especie que toleraría aumentos de CO2 y temperatura, en tanto que la berenjena criolla y el fríjol caupí, en condiciones normales de CO2, los valores de la fotosíntesis neta se verían mermados si la radiación llegara a 2 000 μmol de fotones m-2 s-1 y la temperatura subiera a 30 y 32 °C. En un ambiente hipotético de CO2 aumentado, las tasas de fotosíntesis neta decrecerían en función de las altas temperaturas y niveles de radiación incidente. Las variedades de arroz bogotano y LV presentan un comportamiento similar, al no afectar sus tasas de fotosíntesis neta máximas si la temperatura aumenta y existen concentraciones normales o aumentadas de CO2. El arroz chombo sería más susceptible a altas temperaturas, tanto en ambientes normales como saturados de CO2. De manera similar a los grupos anteriores, los resultados dicen que, en condiciones de atmósferas normales de concentración de CO2, las tasas de fotosíntesis de las especies perennes del café y el cacao fueron afectadas principalmente por las altas temperaturas, pero cuando se aumenta la concentración del CO2, el café sería la especie más sensible a las temperaturas altas. Por su parte, el roble en ambientes normales de CO2 no afectaría sus tasas de fotosíntesis neta máxima con la radiación o temperaturas elevadas, pero sí lo harían conforme aumenta el CO2 y la temperatura a partir de los 30 °C. Por último, los resultados del trabajo confirman que la estabilidad fotosintética de la mayoría de las especies que cultivan los pequeños productores de La Mojana depende en primera instancia del efecto de las temperaturas, principalmente las altas, y que existen recursos fitogenéticos que relativamente podrían adaptarse a estas condiciones.
Referencias
Ainsworth, E. A. y Rogers, A. (2007). The response of photosynthesis and stomatal conductance to rising [CO2]: Mechanisms and environmental interactions. Plant, Cell & Environment, 30(3), 258-270. https://doi.org/10.1111/j.1365-3040.2007.01641.x
Baath, G. S., Northup, B. K., Rao, S. C. y Kakani, V. G. (2021). Productivity and water use in intensified forage soybean-wheat cropping systems of the US southern Great Plains. Field Crops Research, 265, 108086. https://doi.org/10.1016/j.fcr.2021.108086
Chiu, C.-L., Hsiao, I.-F. y Chang, L. (2023). Overviewing global surface temperature changes regarding CO2 emission, population density, and energy consumption in the industry: Policy suggestions. Sustainability, 15(8), 7013. https://doi.org/10.3390/su15087013
Dipierri, A. A. y Zikos, D. (2020). The role of common-pool resources’ institutional robustness in a collective action dilemma under environmental variations. Sustainability, 12(24), 10526. https://doi.org/10.3390/su122410526
Doi, T., Sakurai, G. y Iizumi, T. (2020). Seasonal predictability of four major crop yields worldwide by a hybrid system of dynamical climate prediction and eco-physiological crop-growth simulation. Frontiers in Sustainable Food Systems, 4, 84. https://doi.org/10.3389/fsufs.2020.00084
Drake, J. E., Tjoelker, M. G., Vårhammar, A., Medlyn, B. E., Reich, P. B., Leigh, A., Pfautsch, S., Blackman, C. J., López, R., Aspinwall, M. J., Crous, K. Y., Duursma, R. A., Kumarathunge, D., De Kauwe, M. G., Jiang, M., Nicotra, A. B., Tissue, D. T., Choat, B., Atkin, O. K. y Barton, C. V. M. (2018). Trees tolerate an extreme heatwave via sustained transpirational cooling and increased leaf thermal tolerance. Global change biology, 24(6), 2390-2402. https://doi.org/10.1111/gcb.14037
Duc, N. H., Csintalan, Z. y Posta, K. (2018). Arbuscular mycorrhizal fungi mitigate negative effects of combined drought and heat stress on tomato plants. Plant Physiology and Biochemistry, 132, 297-307. https://doi.org/10.1016/j.plaphy.2018.09.011
Farley, K. A., Tague, C. y Grant, G. E. (2011). Vulnerability of water supply from the Oregon Cascades to changing climate: Linking science to users and policy. Global Environmental Change, 21(1), 110-122. https://doi.org/10.1016/j.gloenvcha.2010.09.011
Fujimori, S., Iizumi, T., Hasegawa, T., Takakura, J. Y., Takahashi, K. y Hijioka, Y. (2018). Macroeconomic impacts of climate change driven by changes in crop yields. Sustainability, 10(10), 3673. https://doi.org/10.3390/su10103673
Galmes, J., Kapralov, M. V., Copolovici, L. O., Hermida-Carrera, C. y Niinemets, Ü. (2015). Temperature responses of the Rubisco maximum carboxylase activity across domains of life: Phylogenetic signals, trade-offs, and importance for carbon gain. Photosynthesis Research, 123, 183-201. https://doi.org/10.1007/s11120-014-0067-8
He, Y. y Matthews, M. L. (2023). Seasonal climate conditions impact the effectiveness of improving photosynthesis to increase soybean yield. Field Crops Research, 296, 108907. https://doi.org/10.1016/j.fcr.2023.108907
Karklelienė, R., Juškevičienė, D. y Radzevičius, A. (2023). Application of genetic resources in the development of new lithuanian vegetable cultivars. Plants, 12(4), 807. https://doi.org/10.3390/plants12040807
Kumari, A., Lakshmi, G.A., Krishna, G.K., Patni, B., Prakash, S., Bhattacharyya, M., Singh, S.K. y Verma, K.K. (2022). Climate change and its impact on crops: A comprehensive investigation for sustainable agriculture. Agronomy, 12(12), 3008. https://doi.org/10.3390/agronomy12123008
Kunimitsu, Y. y Nishimori, M. (2020). Policy measures to promote mid-summer drainage in paddy fields for a reduction in methane gas emissions: The application of a dynamic, spatial computable general equilibrium model. Paddy and Water Environment, 18, 211-222. https://doi.org/10.1007/s10333-019-00775-6
Li, Q., Gao, Y., Hamani, A. K. M., Fu, Y., Liu, J., Wang, H. y Wang, X. (2023). Effects of warming and drought stress on the coupling of photosynthesis and transpiration in winter wheat (Triticum aestivum L.). Applied Sciences, 13(5), 2759. https://doi.org/10.3390/app13052759
Marić, A. Č., Čop, T., Oplanić, M., Ban, S. G. y Njavro, M. (2023). Adaptation to climate change in Adriatic Croatia—The view of policymakers. Sustainability, 15(9), 7085. https://doi.org/10.3390/su15097085
Mathur, S., Agrawal, D. y Jajoo, A. (2014). Photosynthesis: Response to high temperature stress. Journal of Photochemistry and Photobiology B: Biology, 137, 116-126. https://doi.org/10.1016/j.jphotobiol.2014.01.010
Pathirana, R. y Carimi, F. (2022). Management and utilization of plant genetic resources for a sustainable agriculture. Plants, 11(15), 2038. https://doi.org/10.3390/plants11152038
Peña-Lévano, L. M., Taheripour, F. y Tyner, W. E. (2019). Climate change interactions with agriculture, forestry sequestration, and food security. Environmental and Resource Economics, 74, 653-675. https://doi.org/10.1007/s10640-019-00339-6
Pompelli, M. F., Espitia-Romero, C. A., de Diós Jaraba-Navas, J., Rodriguez-Paez, L. A. y Jarma-Orozco, A. (2022). Stevia rebaudiana under a CO2 enrichment atmosphere: Can CO2 enrichment overcome stomatic, mesophilic and biochemical barriers that limit photosynthesis? Sustainability, 14(21), 14269. https://doi.org/10.3390/su142114269
Prieto-Benítez, S., Ruiz-Checa, R., González-Fernández, I., Elvira, S., Rucandio, I., Alonso, R. & Bermejo-Bermejo, V. (2023). Ozone and temperature may hinder adaptive capacity of Mediterranean perennial grasses to future global change scenarios. Plants, 12(3), 664. https://doi.org/10.3390/plants12030664
Rajpal, V. R., Singh, A., Kathpalia, R., Thakur, R. K., Khan, M. K., Pandey, A., Hamurcu, M. y Raina, S. N. (2023). The prospects of gene introgression from crop wild relatives into cultivated lentil for climate change mitigation. Frontiers in Plant Science, 14, 1127239. https://doi.org/10.3389/fpls.2023.1127239
Sánchez-Reinoso, A. D., Ligarreto-Moreno, G. A. y Restrepo-Díaz, H. (2019). Chlorophyll α fluorescence parameters as an indicator to identify drought susceptibility in common bush bean. Agronomy, 9(9), 526. https://doi.org/10.3390/agronomy9090526
Snider, J. L., Thangthong, N., Rossi, C. y Pilon, C. (2022). Root system growth and anatomy of cotton seedlings under suboptimal temperature. Journal of Agronomy and Crop Science, 208(3), 372-383. https://doi.org/10.1111/jac.12591
Sun, Y., Liu, S. y Li, L. (2022). Grey correlation analysis of transportation carbon emissions under the background of carbon peak and carbon neutrality. Energies, 15(9), 3064. https://doi.org/10.3390/en15093064
Tan, X., Li, H., Zhang, Z., Yang, Y., Jin, Z., Chen, W., Tang, D., Wei, C. y Tang, Q. (2023). Characterization of the difference between day and night temperatures on the growth, photosynthesis, and metabolite accumulation of tea seedlings. International Journal of Molecular Sciences, 24(7), 6718. https://doi.org/10.3390/ijms24076718
Tiwari, S., Prasad, V., Chauhan, P. S. y Lata, C. (2017). Bacillus amyloliquefaciens confers tolerance to various abiotic stresses and modulates plant response to phytohormones through osmoprotection and gene expression regulation in rice. Frontiers in Plant Science, 8, 1510. https://doi.org/10.3389/fpls.2017.01510
Urban, J., Ingwers, M. W., McGuire, M. A. y Teskey, R. O. (2017). Increase in leaf temperature opens stomata and decouples net photosynthesis from stomatal conductance in Pinus taeda and Populus deltoides x nigra. Journal of Experimental Botany, 68(7), 1757-1767. https://doi.org/10.1093/jxb/erx052
Verma, P., Yadav, A. N., Khannam, K. S., Panjiar, N., Kumar, S., Saxena, A. K., y Suman, A. (2015). Assessment of genetic diversity and plant growth promoting attributes of psychrotolerant bacteria allied with wheat (Triticum aestivum) from the northern hills zone of India. Annals of Microbiology, 65, 1885-1899. https://doi.org/10.1007/s13213-014-1027-4
Vishwakarma, C., Krishna, G. K., Kapoor, R. T., Mathur, K., Lal, S. K., Saini, R. P., Yadava, P. y Chinnusamy, V. (2023). Bioengineering of canopy photosynthesis in rice for securing global food security: A critical review. Agronomy, 13(2), 489. https://doi.org/10.3390/agronomy13020489
Vitale, L., Vitale, E., Francesca, S., Lorenz, C. y Arena, C. (2023). Plant-growth promoting microbes change the photosynthetic response to light quality in spinach. Plants, 12(5), 1149. https://doi.org/10.3390/plants12051149
Von-Caemmerer, S. y Evans, J. R. (2015). Temperature responses of mesophyll conductance differ greatly between species. Plant, Cell & Environment, 38(4), 629-637. https://doi.org/10.1111/pce.12449
Wang, M., Li, T., Yuan, C., Tian, H. y Tian, S. (2022). Research on vehicle renewable energy use in cities with different carbon emission characteristics. Energy Reports, 8, 343-352. https://doi.org/10.1016/j.egyr.2022.03.064
Wang, X. Q., Zeng, Z. L., Shi, Z. M., Wang, J. H. y Huang, W. (2023). Variation in photosynthetic efficiency under fluctuating light between rose cultivars and its potential for improving dynamic photosynthesis. Plants, 12(5), 1186. https://doi.org/10.3390/plants12051186
Yalcinkaya, T., Uzilday, B., Ozgur, R., Turkan, I. y Mano, J. I. (2019). Lipid peroxidation-derived reactive carbonyl species (RCS): Their interaction with ROS and cellular redox during environmental stresses. Environmental and Experimental Botany, 165, 139-149. https://doi.org/10.1016/j.envexpbot.2019.06.004
Yang J, Feng Y, Chi T, Wen Q, Liang P, Wang A. y Li P. (2023). Mitigation of elevated CO2 concentration on warming-induced changes in wheat is limited under extreme temperature during the grain filling period. Agronomy, 13(5),1379. https://doi.org/10.3390/agronomy13051379
Zhou, R., Kong, L., Yu, X., Ottosen, C. O., Zhao, T., Jiang, F. y Wu, Z. (2019). Oxidative damage and antioxidant mechanism in tomatoes responding to drought and heat stress. Acta Physiologiae Plantarum, 41, 1-11. https://doi.org/10.1007/s11738-019-2805-1
Notas
i La investigación se realizó en 2022 en la región de La Mojana, en el municipio de San Marcos, departamento de Sucre (Colombia), en el marco del Programa Mojana Clima y Vida liderado por el Fondo Adaptación, junto con el Programa de las Naciones Unidas para el Desarrollo y el Ministerio de Ambiente y Desarrollo Sostenible, y financiado por el Fondo Verde del Clima. El programa tiene como objeto mejorar la resiliencia al clima de las comunidades vulnerables en la región de La Mojana durante las temporadas prolongadas de inundación y de sequía, así como el impacto en poblaciones rurales y gobiernos locales.
ii Coinvestigador. Ingeniero agrónomo, estudiante candidato a M.Sc. en Fisiología de Cultivos, Universidad de Córdoba (Colombia). Contribución específica al presente artículo: redacción e interpretación de resultados. aarizagonzalez28@correo.unicordoba.edu.co
iii Investigador principal. Ph.D. en Fisiología de Cultivos de la Universidad Nacional de Colombia, sede Bogotá. Profesor investigador en la Universidad de Córdoba (Colombia). Entre sus últimas publicaciones se encuentran: “Physiological and Enzymatic Evaluation of Selected Genotypes of Stevia rebaudiana Bertoni”, artículo publicado en 2023 en Agronomy (13[2], 403, https://doi.org/10.3390/agronomy13020403); e “Imbibition and Germination of Seeds with Economic and Ecological Interest: Physical and Biochemical Factors Involved”, publicado en 2023 en Sustainability (15[6], 5394, https://doi.org/10.3390/su15065394). Contribución específica al presente artículo: redacción e interpretación de resultados. ajarma@correo.unicordoba.edu.co
iv Coinvestigador. Ph.D. en Suelos de la Universidad Federal de Viçosa (Brasil). Profesor investigador en la Universidad de Córdoba (Colombia). Entre sus últimas publicaciones se encuentran: “Physiological and Enzymatic Evaluation of Selected Genotypes of Stevia rebaudiana Bertoni”, artículo publicado en 2023 en Agronomy (13[2], 403, https://doi.org/10.3390/agronomy13020403); y “Phytoremediation of Soils Contaminated with Heavy Metals from Gold Mining Activities Using Clidemia sericea D. Don.”, publicado en 2022 en Plants (11[5], https://doi.org/10.3390/plants11050597). Contribución específica al presente artículo: redacción e interpretación de resultados. emcombatt@correo.unicordoba.edu.co
v Coinvestigador. Especialista en Administración Total de la Calidad, Universidad de Córdoba (Colombia). Contribución específica al presente artículo: supervisión y redacción de resultados. juanguzman@correo.unicordoba.edu.co
vi Coinvestigador. M.Sc. en Biotecnología de la Universidad Instituto Tecnológico El Llano (México). Profesor investigador en la Universidad de Córdoba (Colombia). Entre sus últimas publicaciones se encuentran: “Physiological and Enzymatic Evaluation of Selected Genotypes of Stevia rebaudiana Bertoni”, artículo publicado en 2023 en Agronomy (13[2], 403, https://doi.org/10.3390/agronomy13020403; e “Imbibition and Germination of Seeds with Economic and Ecological Interest: Physical and Biochemical Factors Involved”, publicado en 2023 en Sustainability (15[6], 5394, https://doi.org/10.3390/su15065394). Contribución específica al presente artículo: redacción e interpretación de resultados. larguez@correo.unicordoba.edu.co
vii Coinvestigador. Ph.D. en Fitopatología de la Universidad de Arkansas (EE. UU.). Profesor investigador en la Universidad de Córdoba (Colombia). Entre sus últimas publicaciones se encuentran: “Physiological and Enzymatic Evaluation of Selected Genotypes of Stevia rebaudiana Bertoni”, artículo publicado en 2023 en Agronomy (13[2], 403, https://doi.org/10.3390/agronomy13020403); y “Stevia rebaudiana under a CO2 Enrichment Atmosphere: Can CO2 Enrichment Overcome Stomatic, Mesophilic and Biochemical Barriers That Limit Photosynthesis?”, publicado en 2022 en Sustainability (14[21], 14269, https://doi.org/10.3390/su142114269). Contribución específica al presente artículo: redacción e interpretación de resultados. jjaraba@correo.unicordoba.edu.co
viii Coinvestigador. M.Sc. en Desarrollo Sostenible y Medio Ambiente de la Universidad de Manizales (Colombia). Analista agroecológico del PNUD. Contribución específica al presente artículo: supervisión y revisión. wilber.ramirez@undp.org
ix Coinvestigadora. M.Sc. en Derechos humanos y Derecho Internacional Humanitario del Instituto Europeo Campus Stellae (España). Jefa del Proyecto “Mojana, Clima y Vida” del PNUD. Contribución específica al presente artículo: supervisión y revisión. diana.diaz@undp.org
x Coinvestigadora. Grado en Ingeniería Agrícola de la Universidad Surcolombiana (Colombiana). Asociada técnica en agroecosistemas del PNUD. Contribución específica al presente artículo: supervisión y revisión. nathalie.leal1@undp.org
xi Coinvestigadora. M.Sc. en Desarrollo Sostenible y Medio Ambiente de la Universidad de Manizales (Colombia). Asociada técnica en agroecosistemas del PNUD. Contribución específica al presente artículo: supervisión y revisión. yanira.jimenez@undp.org